Nettoyage
Le nettoyage est le processus d'élimination des substances indésirables, telles que la saleté, les agents infectieux et autres impuretés, d'un objet ou d'un environnement. Le nettoyage se produit dans de nombreux contextes différents et utilise de nombreuses méthodes différentes. Plusieurs métiers sont consacrés au nettoyage. Le nettoyage a différents objectif dont la propreté et l'hygiène, etc.
Contextes
Le nettoyage a lieu dans divers contextes commerciaux, domestiques, personnels et environnementaux, qui diffèrent par leur échelle et leurs exigences.
- Nettoyage commercial (en)
- Terminal cleaning (en), dans les établissements de santé
- Assainissement de l'environnement, élimination de la pollution ou des contaminants du milieu naturel
- Tâches ménagères, y compris le nettoyage de printemps
- Hygiène, y compris le toilettage personnel.
Méthodes
Le nettoyage est généralement réalisé par une action mécanique et/ou une action de solvant ; de nombreuses méthodes reposent sur les deux processus.
- Lavage généralement fait avec de l'eau et souvent une sorte de savon ou de détergent
- Lavage sous pression, utilisant un jet d'eau à haute pression
- Le décapage abrasif, généralement utilisé pour éliminer le matériau en vrac d'une surface, peut également être utilisé pour éliminer les contaminants
- Nettoyage acoustique (en), utilisation d'ondes sonores pour secouer les particules des surfaces
- Nettoyage par ultrasons, utilisant des ultrasons, généralement de 20 à 400 kHz
- Nettoyage mégasonique (en), un mécanisme plus doux que le nettoyage par ultrasons, utilisé dans le nettoyage des wafers, des implants médicaux et des pièces industrielles
- Nettoyage au dioxyde de carbone (en), une famille de méthodes de nettoyage et de stérilisation des pièces utilisant du dioxyde de carbone dans ses différentes phases
- Nettoyage à sec de vêtements et textiles, à l'aide d'un solvant chimique autre que l'eau
- Nettoyage à la flamme (en) de l'acier de construction avec une flamme oxyacétylénique
- Nettoyage écologique (en), utilisant des méthodes et des produits respectueux de l'environnement
- Nettoyage au plasma (en), utilisant un plasma énergétique ou un plasma de décharge à barrière diélectrique créé à partir de divers gaz
- Nettoyage par pulvérisation, effectué sous vide en utilisant la pulvérisation physique de la surface
- Nettoyage à la vapeur (en), dans des contextes domestiques et industriels
- Nettoyage thermique (en), en milieu industriel, impliquant pyrolyse et oxydation
- Nettoyage humide (en), méthodes de blanchissage professionnel qui évitent l'utilisation de solvants chimiques
Nettoyage par article
Certains articles et matériaux nécessitent des techniques de nettoyage spécialisées, en raison de leur forme, de leur emplacement ou des propriétés matérielles de l'objet et des contaminants.
Bâtiments et infrastructures
- Nettoyage des plages (en)
- Nettoyage de tapis (en)
- Nettoyage de cheminée (en)
- Nettoyage de scène du crime (en)
- Nettoyage extérieur (en)
- Nettoyage des sols (en)
- Élimination des graffitis (en)
- Nettoyage de toiture (en)
- Nettoyage des silos
- Nettoyage des rues
Autres éléments
- Nettoyage des monnaies (en)
- Nettoyage de bijoux (en)
- Blanchisserie, lavage des vêtements et autres textiles
- Nettoyage de pièces (en), dans l'industrie
- Lavage de marmites (en), en restauration
- Brossage de dents (en)
- Nettoyage des tubes (en)
Emplois du nettoyage et professions impliquant l'entretien et le nettoyage
Plusieurs professions impliquent le nettoyage, soit dans leur intégralité, soit entre autres tâches.
Parmi les métiers du nettoyage, se trouvent notamment :
Voir aussi
Général
Biologie et santé
- Nettoyage symbiotique, parmi les créatures vivantes
- Hygiène, un ensemble de pratiques au service de la préservation de la santé
- Assainissement, des techniques pour protéger la santé humaine en fournissant un environnement propre
- Stérilisation (microbiologie), l'élimination ou la désactivation d'agents biologiques
Autres contextes
- Cleaning event (en), dans lequel les panneaux solaires des rovers planétaires sont nettoyés par le vent
- Cleaning validation (en), utilisé pour garantir l'élimination des résidus de fabrication
- Salle blanche, une salle avec de faibles niveaux de particules, utilisée dans la fabrication spécialisée ou la recherche
- Priming (science), nettoyage de l'équipement scientifique avec le même produit chimique qui sera utilisé dans une expérience
Éponge (objet)
| Matériaux |
|---|
| Usage |
|---|
L'éponge est un objet d'origine animale ou synthétique.
Sa structure poreuse (il s'agit d'une mousse solide ouverte) lui confère une forte capacité d'absorption atteignant vingt-deux fois sa masse sèche pour les éponges animales. C'est pourquoi son usage principal est la toilette et le lavage en général.
Les éponges peuvent être d'origine naturelle : animale (éponges de mer) ou végétale (luffa), artificielle : provenant de la transformation d'un polymère naturel comme la cellulose (éponge cellulosique), ou synthétique : éponge en polyuréthane.
Éponges animales
Histoire
Il semble qu'elles aient été exploitées dès deux siècles avant notre ère par les Crétois[réf. nécessaire]. Ces éponges marines sont des squelettes d'animaux marins appelés Porifera.
Traitement chimique moderne
Les différentes étapes du traitement sont :
- l'élimination du calcaire par une solution d'acide chlorhydrique ;
- la stérilisation par une solution de permanganate de potassium ;
- le blanchiment par de l'eau oxygénée ;
- les lavages.
Éponges végétales
Du fait de la qualité de ses fibres, une section de fruit de Luffa (une cucurbitacée) peut servir d'éponge naturelle.
Éponges synthétiques végétales
Histoire
Les éponges synthétiques végétales sont issues des recherches sur la viscose et sont lancées en France en 1935. Bien que possédant un pouvoir absorbant 3 fois inférieur à celui d'une éponge animale, elles restent moins chères et plus résistantes que cette dernière.
Ce type d'éponge représente maintenant 85 % des éponges synthétiques vendues en France1.
Mode de fabrication
Les éponges cellulosiques sont fabriquées de toutes pièces.
On utilise pour cela de la cellulose (extrait de bois, principalement) auquel on ajoute colorants, fibres et du sulfate de sodium, élément permettant de créer les trous de l'éponge2. Le tout est cuit, lavé puis découpé pour donner la base de l'éponge3.
Autres éponges synthétiques
Histoire
Les éponges synthétiques sont un substitut encore moins cher et plus résistant aux éponges synthétiques végétales, mais possédant un pouvoir d'absorption encore inférieur[réf. nécessaire]. Elles sont issues de l'industrie pétrochimique, ce qui les rend non biodégradables.
Mode de fabrication
Les éponges synthétiques sont issues d'une réaction chimique entre du benzoate polymérique et un aluminium fin.
D'autres éponges pour des applications avancées sont fabriquées par d'autres méthodes comme des éponges à base de mélamine partiellement carbonisée pour la dépollution des eaux4.
Notes et références
- delautrecotedeseponges, « Les éponges artificielles » [archive], sur Skyrock, (consulté le )
- « How sponge is made - material, manufacture, making, used, steps, product, industry, machine » [archive], sur www.madehow.com (consulté le )
- (en) Bonnier Corporation, Popular Science, Bonnier Corporation, (lire en ligne [archive]), p. 132-135,208
- (en) Aude Stolz, Sylvie Le Floch, Laurence Reinert et Stella M. M. Ramos, « Melamine-derived carbon sponges for oil-water separation », Carbon, vol. 107, , p. 198–208 (ISSN 0008-6223, DOI 10.1016/j.carbon.2016.05.059, lire en ligne [archive], consulté le ).
Voir aussi
Articles connexes
Balai
| Matériau |
Genista bristle (d)
|
|---|
| Usage |
Sweeping (d)
|
|---|
Un balai est un outil de nettoyage des sols composé d'une brosse, d'un faisceau de branchettes ou bien de fibres naturelles ou synthétiques. Y est souvent fixé un long manche permettant à l'utilisateur de s'en servir debout.
Historique
Initialement, les balais étaient de forme ronde et composés de fibres naturelles, paille ou fagots de bois.
Entre la fin du XVIe et le début du XVIIe siècle, selon Béatrice Fontanel1 apparait la propreté des intérieurs.
Jusqu’à la fin du XVIIIe siècle, ces outils de nettoyage, dans leur forme rudimentaire, étaient principalement constitués de branches attachées dans un tas avec un manche fait à partir d’une grosse branche.
« C’est surtout lorsque les sols des fermes, à l’origine en terre battue, ont été revêtus de dalles de pierre ou de carreaux de terre cuite, que les ménagères ont entrepris un ménage plus soigneux. Les balais se perfectionnèrent progressivement car sur un sol dur et lisse, ils devaient être souples pour être efficaces. Ceux en soie de porc étaient les plus recherchés, alors que les plus modestes étaient fabriqués avec des brindilles de bouleau que les artisans réunissaient en faisceau en les maintenant par un lien en baguette de coudrier ou de saule. Le manche, dans la plupart des cas une solide branche de frêne, était fixé à cette extrémité »2.
Aux États-Unis : En 1797, un balai en sorgho est inventé puis commercialisé
2.
Le mot balai est issu du breton balan (genêt)3, lui-même du gaulois balano- « genêt »4.
Les fibres utilisées aujourd'hui sont le plus souvent en matière synthétique.
outils dérivés
- Le balai-brosse est un balai plat à poils très courts et rigides, traditionnellement fabriqués en racines de chiendent et de plus en plus en fibres synthétiques. Il sert à brosser les sols très encrassés ou de support à une serpillère. Il est également appelé « lave-pont », car il était utilisé sur les bateaux dont il servait à nettoyer le pont.
- Le balai à franges, appelé mop en anglais, et utilisé pour dépoussiérer, ou mocho, d'origine espagnole, conçu à Saragosse, par Manuel Jalón Corominas, pour nettoyer les sols à l'eau, conçu pour être utilisé avec un seau à essorage.
- La balayette est un petit balai à main, utilisé pour rassembler la poussière vers une pelle, ou pour nettoyer des endroits peu accessibles.
- La machine balai pour nettoyer les voiries a été inventée en 1836-37 (à Lyon), usage en Angleterre, à Manchester5.
- Le balai mécanique, inventé par Melville Bissell en 1876, est composé d'un réservoir plat vers lequel les poussières sont envoyées par des brosses rondes tournantes, actionnées par le mouvement du balai sur le sol ; il est utilisé sur les moquettes et les tapis.
- Le balai de sorgho étapes de fabrication du balai de sorgho à Grisolles.
- Le balai à plat, hybride entre un balai et une serpillère pouvant servir à la fois à dépoussiérer les sols mais aussi à les laver. Il est composé d'un manche et d'une platine plate d'où il tire son nom de balai à plat.
- L'aspirateur
- Le balai de toilettes
- Le faubert, pour nettoyer le pont des bateaux
- Le balai de curling, accessoire utilisé pour balayer la surface de glace à l'avancée de la pierre
Balais et sorcières
Les balais ont été longtemps associés aux sorcières, qui sont très souvent représentées à califourchon, volant sur un balai magique (voir aussi balai magique dans Harry Potter).
Mœurs
Les balais sont autant un outil qu'un symbole social. En effet, les tâches ménagères sont souvent déléguées aux classes populaires. Son utilisation peut avoir une connotation négative pour certaines personnes. Les balais sont aussi le symbole de la femme au foyer, stéréotype marquant des siècles précédents.
Notes et références
- Béatrice Fontanel, Nos maisons. Du Moyen Age au XXe siècle, ed. Seuil, 2010, « La propreté hollandaise devint légendaire, véhiculée par les récits de nombreux étrangers stupéfiés d’entrer dans des maisons aussi bien astiquées que celles d’Amsterdam ou d’Utrecht...Le foyer devenait alors un espace particulièrement soigné, très nettement séparé de la fange de la rue. » source le GdS [archive] (consulté le 18/01/2020).
- GdS [archive] (consulté le 18/01/2020).
- Site du CNRTL : étymologie de balai [archive]
- Xavier Delamarre (préf. Pierre-Yves Lambert), Dictionnaire de la langue gauloise : une approche linguistique du vieux-celtique continental, Paris, Errance, coll. « Hespérides », , 440 p. (ISBN 978-2-87772-237-7, OCLC 716563373), p. 64 - 65
- Philippe Dufieux, « A propos de l'hygiène de Lyon (1800 - 1914) », dans Lyon, centre du monde ! L'exposition internationale urbaine de 1914, p=173.
Annexes
Articles connexes
Aspirateur
Un aspirateur, aussi appelé balayeuse au Canada (les deux termes y sont employés indistinctement), est un appareil électroménager muni d’une pompe à air créant une dépression qui provoque l’aspiration de poussière et de petits déchets tombés au sol. Ce type d’outil sert au nettoyage des moquettes et des tapis, ainsi que des parquets et autres surfaces.
Trois technologies principales sont utilisées pour piéger la poussière : par passage dans un sac qui fait office de filtre primaire, par passage dans un collecteur démontable rigide à l’aide d’un système de séparation à cyclone, et par bullage dans de l'eau.
Historique
Les ancêtres des aspirateurs sont des balais à tapis. L'ancêtre direct de l'aspirateur était un balai à tapis inventé en 1860 par Daniel Hess. Il fonctionnait à l'aide de soufflets permettant de créer du vide.
Le premier système de nettoyage utilisant le vide pour aspirer la poussière était manuel. Il s'agit du Whirlwind, inventé à Chicago en 1869 par Ives W. McGaffey1. Cette machine légère et compacte était toutefois difficile à utiliser car il fallait tourner une manivelle tout en la poussant sur le sol. Breveté le , cet appareil était vendu pour 25 $, un prix très élevé pour l'époque. On ne sait pas quel fut le succès du Whirlwind, mais la plupart des appareils ayant été vendus à Chicago et à Boston, on peut penser que la plupart ont été perdus dans le grand incendie qui ravagea Chicago en 1871. Seuls deux exemplaires nous sont parvenus, dont l'un se trouve au Hoover Historical Center (en Ohio).
L'aspirateur motorisé a été inventé en 1901 par Hubert Cecil Booth, un ingénieur britannique. Celui-ci avait remarqué que le nettoyage des sièges de trains par époussetage serait avantageusement remplacé par un système qui aspirerait la poussière au lieu de la faire s'envoler ailleurs. Après avoir essayé lui-même d'aspirer la poussière d'un des sièges à travers un mouchoir, il a mis en pratique le procédé dans un appareil connu sous le nom de Puffing Billy. Cet encombrant système avec des tuyaux de 30 m de long devait être tracté par des chevaux devant le bâtiment à nettoyer, la succion étant provoquée par un moteur à essence. Trop contraignante, l'invention de Booth n'a pas connu de réel succès, la compagnie GBooth's Vacuum Cleaner Co Ltd étant poursuivie à plusieurs reprises pour avoir effrayé les chevaux des fiacres dans la rue2.
En 1902, l'Américain David T. Kenney, installe dans un hôtel de New York le premier aspirateur électrique fixe de dépoussiérage mécanique qui utilise exclusivement le vide pour nettoyer3.
En 1905, le Griffith's Improved Vacuum Apparatus for Removing Dust from Carpets (« Appareil à vide amélioré de Griffith pour enlever la poussière des tapis ») est breveté par Walter Griffiths. Il s'agit d'un nouveau système manuel facilement transportable, facile à ranger et qui peut être utilisé par une seule personne. L'opérateur doit presser un système de soufflet qui aspire la poussière via un tuyau flexible et amovible auquel plusieurs embouts peuvent être attachés. Il s'agit du premier aspirateur domestique comparable aux aspirateurs actuels.
En 1906, James M. Spangler, concierge de Canton dans l'Ohio, invente un aspirateur électrique à partir d'un ventilateur, d'une boîte et d'une taie d'oreiller. Le modèle de Spangler intègre également une brosse rotative pour décoller plus facilement la poussière. Breveté en 1908, le système est vendu à l'entreprise de son cousin William Hoover : Hoover Harness and Leather Goods Factory, qui le nomme balai à succion mécanique. Hoover reste l'un des leaders mondiaux de l'aspirateur, si bien que le mot est passé dans le langage courant (en Angleterre, on appelle hoover l'aspirateur tandis que « passer l'aspirateur » se dit couramment to hoover).
L'aspirateur, de l'entre-deux-guerres était appelé « électrobonne », un luxe jusque dans les années 1920, avant de se démocratiser après la Seconde Guerre mondiale4. Il s'est aujourd'hui généralisé dans les pays développés.
Des modèles sans sac, à « séparation cyclonique », sont proposés commercialement pour la première fois par FilterQueen en 1939, une marque de Health-Mor Industries, Dyson a présenté un modèle commercial en 1979; des modèles dont un bac à eau remplace filtre et sac existent également. Sont apparus ensuite des robot aspirateurs.
En , la Commission européenne s'attaque à la puissance des aspirateurs en la limitant à 1 600 W. Un objectif de 900 W de consommation a été fixé pour 5. La Commission pense ainsi pouvoir réduire de 20 TWh par an la consommation d'électricité dans l'Union européenne6.
Typologie
On dénombre plusieurs types d'aspirateurs, le plus connu étant l'aspirateur à poussière.
Certains aspirateurs permettent l'aspiration de liquides, et certains permettent d'aspirer eau et poussières (ils sont dits « mixtes »).
Dans certains milieux tels les cinémas, les salles de conférence et les trains, les agents utilisent des aspirateurs dorsaux. Sur batterie ou secteur, ils permettent des déplacements plus rapides.
Citons également l'aspiro-brosseur (aspirateur vertical), muni comme son nom l'indique d'une brosse électrique. Cette dernière permet un nettoyage en profondeur de la moquette. Néanmoins, sur le long terme, elle provoque l'usure du revêtement.
Depuis une dizaine d’années, les aspirateurs sans sac ont fait leur apparition et grignotent peu à peu les parts de marché des modèles traditionnels.
Le tuyau est appelé flexible, le manche est nommé canne et l'embout a pour nom le suceur.
Aspirateur centralisé
L'aspirateur centralisé est un type d'aspirateur encastré dans les murs d'un immeuble ou d'une maison. C'est un système d'aspiration basé sur l'installation de conduits (PVC blanc 50,8 mm2) antistatique à l'intérieur même des murs de l'habitation.
Robot aspirateur
Un robot aspirateur est un aspirateur robotisé, c'est-à-dire capable de réaliser le travail d'un aspirateur de manière autonome, sans intervention d'un être humain. C'est en 2009 que s'ouvre le principal marché de robots domestiques dans le monde.
Aspirateur sans sac
Les aspirateurs portables basés sur le principe de la séparation cyclonique sont devenus populaires dans les années 1990. Ce principe de séparation de la poussière était bien connu et souvent utilisé dans les centrales à videa. Ce brevet lui permit de développer ses aspirateurs FilterQueen7.
En 1979, James Dyson introduit un appareil portatif de séparation cyclonique, adaptation d'un système d'aspiration de sciure qu'il avait découvert dans une scierie industrielle8. Il lance d'abord son aspirateur à cyclone au Japon, dans les années 1980, au coût d'environ US$1800 et, en 1993, il sort son modèle vertical Dyson DC01 au Royaume-Uni au prix de £200. Les critiques s'attendaient à ce que les gens refusent d'acheter un aspirateur pour le double du prix d'un modèle conventionnel, mais le système Dyson est devenu plus tard le système de nettoyage le plus populaire au Royaume-Uni9,10.
Les aspirateurs cycloniques n'utilisent pas de sacs de filtration. La poussière est récoltée dans un récipient cylindrique amovible. L'air et les poussières sont aspirés à haute vitesse dans le récipient de prélèvement, tangentiellement à la paroi, créant ainsi un tourbillon rapide ou vortex. De par la force centrifuge, les particules de poussière et autres débris se rassemblent sur la paroi d'où elles tombent par gravité.
Dans les installations fixes d'aspirateur central, l'air propre du centre du vortex peut être éjecté directement vers l'extérieur, sans besoin de filtration supplémentaire. Dans les modèles cyclonique portables, l'air propre au centre du vortex est expulsé de l'appareil après son passage par une succession de filtres, de plus en plus fins. Le premier filtre est destiné à piéger les particules qui peuvent endommager les filtres plus fins. Les filtres doivent être régulièrement nettoyés ou remplacés afin de continuer à assurer à l'appareil un fonctionnement efficace.
Un système cyclonique bien conçu ne perd de sa capacité d'aspiration que lorsque le récipient de collecte de poussière est presque plein. Ceci contraste avec les systèmes à sac, qui perdent leur capacité d'aspiration lorsque les pores du filtre se bouchent progressivement par la récolte de saleté et de poussière.
Le succès de Dyson a contribué à sensibiliser le public à la séparation cyclonique. Plusieurs autres fabricants ont dès lors introduit des modèles cycloniques. Les fabricants concurrents comprennent Rowenta, Hoover, Bissell, Shark, Eureka, Electrolux, Filter Queen, etc., et les modèles les moins chers ne sont pas plus chers qu'un aspirateur classique.
Entretien
Pour conserver l'efficacité d'un modèle traditionnel, il est conseillé de :
- changer le sac papier lorsqu'il est plein aux deux tiers ;
- changer régulièrement le(s) filtre(s) moteur (tous les 5 à 10 sacs environ) ;
- changer les batteries.
- inspecter l'état général de l'aspirateur et de ses accessoires (fils dénudés, bruits anormaux, pertes d'aspiration, accessoires cassés...)
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Vacuum cleaner » (voir la liste des auteurs).
Notes
- P. A. Geier, une entreprise de Cleveland, avait obtenu un brevet d'aspirateur cyclonique dès 1928, qui fut vendu en 1939 à Health-Mor
Références
- Non trouvé le 4 février 2022 [archive], ideafinder.com
- (en) Pauline Webb et Mark Suggitt, Gadgets and necessities : an encyclopedia of household innovations, ABC-CLIO, , p. 131
- (en) Maxwell Stephens Cooley, Vacuum Cleaning Systems. A Treatise on the Principles and Practice of Mechanical Cleaning, Heating and Ventilating Magazine Company, , p. 11
- Michelle Perrot, Mon histoire des femmes, Seuil, , p. 159
- European Commission, Commission Regulation (EU) No 666/2013 of 8 July 2013 implementing Directive 2009/125/EC of the European Parliament and of the Council with regard to ecodesign requirements for vacuum cleaners., (lire en ligne [archive])
- Guide du consommateur pour des aspirateurs économes en énergie [archive], sur ec.europa.eu (consulté le 4 février 2022)
- (en) History of HMI Industries, Inc. – FundingUniverse [archive]. Fundinguniverse.com. Retrieved .
- A new idea. dyson.co.uk
- Against the Odds: An Autobiography: Amazon.co.uk: James Dyson: Books [archive]. Amazon.com. Retrieved 19 June 2012.
- The Origin of Things : Sketches, Models, Prototypes, Rotterdam, NAi Publishers, , te Duits, Thimo éd., 279 p. (ISBN 978-90-5662-318-0)
Voir aussi
Article connexe
Liens externes
-
Notices dans des dictionnaires ou encyclopédies généralistes
- Précautions sanitaires concernant les aspirateurs en période d'épidémie COVID-19 sur Coronavir.org [archive]
Serpillière
Une serpillière ou serpillère est un morceau de toile grossière et résistante, de forme plus ou moins régulière et d'environ 50 cm de côté, servant à laver les sols à l'eau savonneuse (ou avec d’autres liquides). On la passe sur les sols durs et résistant à l'eau (ni la moquette, ni la terre battue, etc.) à l'aide d'un balai-brosse. Le lavage exploite le frottement du tissu sur le sol et la mise en suspension (ou, dans une moindre mesure, en solution) de la saleté dans l'eau. L'eau exerce en outre une action de lubrification qui limite l'usure de l'objet. La serpillière retient une grosse quantité d'eau par capillarité, laissant un sol humide mais séchant très rapidement. Toutefois, l'humidité peut a contrario aussi coller la poussière au sol.
On désigne également par serpillière un balai particulier destiné à laver les sols, dont l'extrémité est munie de franges (coton, tissu) ou d'un support à lingettes. Certains balais à serpillière comprennent un dispositif mécanique d'essorage, intégré au balai, ou au seau associé (serpillière « espagnole » par exemple).
Histoire
À l'origine, la serpillière était une toile grosse et claire servant aux marchands à emballer leurs marchandises1. De coût moindre que la toile classique, elle servait aussi de tablier1, de pare-soleil2, de tapis de selle3 ou même de linceul4. La serpillière usée servait alors de torchon2. Ce n'est qu'au cours du XIXe siècle que cette toile semble dévolue au nettoyage du sol5,6 bien qu'on lui préfère parfois, pour des raisons d'économie, les couvertures usées7. À la fin du XIXe siècle, des règlements en préconisent l'usage en lieu et place du balai dans les hôpitaux8 et les casernes9 pour des raisons de meilleure hygiène.
Odeur
L'odeur de vieille serpillière, comme celle de serviette mouillée, provient de la prolifération de bactéries et de levures (notamment de Rhodotorula glutinis (en)) rejetant des acides organiques volatils qui, en présence d'eau, se dissolvent et deviennent alors perceptibles[réf. nécessaire]10.
Variantes régionales
La serpillière est :
- le torchon ou la loque à reloqueter des francophones de Belgique ;
- le torchon de plancher des Lorrains ;
- la bâche des Champenois ;
- la since des Charentais et des poitevins ;
- la gueille ou guelha en occitan gascon bordelais ou en bordeluche11 ;
- le duel ou la wazing (prononcer [ouassingue]) des Dunkerquois ;
- le patin des Valdôtains12 ;
- la toile ou tela, la frégone ou fregona, le fregador et la torca des Catalans ;
- la toile à pavés des Normands ; On rencontre aussi le terme toile en Haute Bretagne ainsi que dans la Nièvre. En ce qui concerne plus particulièrement la Manche, on relève son emploi dialectal sporadique, sous la forme [twèl], dans le Cotentin et le nord du Saint-Lois.13,14,15,16
- la loque à loqueter en rouchi valenciennois ;
- la panosse de Suisse romande17, de Savoie et de certains Jurassiens et Lyonnais ou la panòssa des occitan auvergnats ;
- la vadrouille ou la moppe (de l'anglais mop) des Québécois et des Acadiens ;
- le faubert ou la vadrouille dans la marine ;
- la pata des occitans Provençaux et vivaro-alpins18 ;
- la pièce ou pèça des occitans Provençaux18;
- la peille ou pelha ou pelhòt des Occitans19[réf. non conforme] ;
- la charpillère en Verduno-Chalonnais6 ;
- et, globalement, la wassingue dans le Nord de la France5.
Une enquête linguistique récente a permis de cartographier avec précision l'aire géographique de ces différentes dénominations20.
Notes et références
- Dictionnaire de l'Académie française, Firmin Didot frères, 1835, p. 735 [archive].
- Jacques Savary des Bruslons, Philemon-Louis Savary, Dictionnaire universel de commerce, 1741, vol. 3, p. 509 [archive].
- F. Joseph Cardini, Dictionnaire d'hippiatrique et d'équitation, Bouchard-Huzard, 1845, p. 468 [archive].
- Matthieu Joseph Bonaventure Orfila, Traité de Médecine légale, Béchet, 1836, p. 29 [archive].
- Société d'agriculture, sciences et arts, Mémoires de la société d'agriculture, sciences & arts centrale du département du Nord séant a Douai, 1852, p. 130 [archive].
- François Fertiault, Dictionnaire du langage populaire verduno-chalonnais (Saône-et-Loire), 1896, p. 78 [archive], Charpillère.
- Recueil des circulaires, instructions et autres actes émanés du Ministère de la justice ou relatifs à ce département, Impr. administrative, 1854, circulaire no 1542 [archive].
- Henri Huchard, Albert Robin, Charles Eloy, Charles Albert Fiessinger, Revue générale de clinique et de thérapeutique : Journal des praticien, s.n., 1898, p. 360 [archive].
- Note ministérielle du au sujet de la nécessité de l'initiative pourra assurer le maintien de la santé des troupes [PDF] [archive].
- « Serviettes de bain : la maison des microbes » [archive], sur www.franceinter.fr (consulté le ).
- L'association « le Haillan Généalogie Histoire », « Le Bordeluche, G » [archive] (consulté le ).
- Jean-Pierre Martin, Description lexicale du français parlé en Vallée d'Aoste, éd. Musumeci, Quart, 1984.
- René Lepelley, Dictionnaire du français régional de Basse-Normandie, Paris, Bonneton, 1989, p. 138a.
- René Lepelley, Dictionnaire du français régional de Normandie, Paris, Bonneton, 1993, p. 140b.
- Pierre Rézeau (éd.), Dictionnaire des régionalismes de France, De Boek Duculot, Bruxelles, 2001, p. 976b.
- Patrice Brasseur, Atlas Linguistique et Ethnographique Normand, CNRS, Paris, vol. IV, OUEN / PUC, Caen, 2011, carte no 1076, « Serpillière ».
- Pascal Singy, L'image du français en Suisse romande : une enquête sociolinguistique en Pays de Vaud, Éditions L'Harmattan, 1996, p. 172 [archive].
- (oc) « dicod'Òc - Recèrca » [archive], sur locongres.org (consulté le ).
- [1] [archive].
- Mathieu Avanzi, « La serpillière 2.0 » [archive], sur Français de nos régions, (consulté le ).
Eau de Javel
Pour les articles homonymes, voir Javel.
| Hypochlorite de sodium | |
 |
|
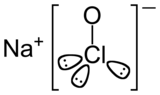
| Structure chimique de l'hypochlorite de sodium. | |
| Identification | |
|---|---|
| Nom UICPA | hypochlorite de sodium |
| Synonymes |
oxychlorure de sodium |
| No CAS | |
| No CE | 231-668-3 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | solution limpide, jaunâtre, d'odeur caractéristique1 |
| Propriétés chimiques | |
| Formule | NaClO |
| Masse molaire2 | 74,442 ± 0,002 g/mol Cl 47,62 %, Na 30,88 %, O 21,49 %, |
| Propriétés physiques | |
| T° fusion | −24,5 °C (pentahydrate)[réf. souhaitée] |
| T° ébullition | 111 °C[réf. souhaitée] |
| Solubilité | 94,2 g dans 100 g d'eau (à 23 °C) (pentahydrate)[réf. souhaitée] |
| Masse volumique | 1,1 g cm−3 (solution aqueuse, 5,5 %), 1,21 g cm−3 (solution aqueuse, 14 %)1 |
| Précautions | |
| SGH | |
| H335 | |
| NFPA 704 | |
| Directive 67/548/EEC | |
| Transport | |
| Inhalation | Dangereuse, peut être mortelle |
| Peau | Irritant, provoque des brûlures, peut être mortelle |
| Yeux | Irritant, provoque des brûlures |
| Ingestion | Dangereuse, voire mortelle |
| Autre | Intraveineuse : irritant, provoque des infections |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'eau de Javel (appelée aussi javel ou anciennement eau de Javelle3,4) est une solution liquide oxydante fréquemment utilisée comme désinfectant et comme décolorant.
Étudiée particulièrement à partir de 1775 par le chimiste Claude-Louis Berthollet, dont la manufacture de produits chimiques a été construite dans le quartier de Javel à Paris, elle est composée d'hypochlorite de sodium pur (NaClO), en solution aqueuse avec du sel (NaCl), résiduel du procédé de fabrication.
La réaction de fabrication de l'eau de Javel (NaClO) à partir de dichlore et de soude (NaOH) est : Cl2 + 2 NaOH → NaCl + NaClO + H2O.
L'eau de Javel est une solution basique, dont le pH varie en fonction de la concentration (pH = 11,5 pour l'eau de Javel à 2,6 % de chlore actif ; pH = 12,5 pour l'eau de Javel concentrée à 9,6 % de chlore actif)5.
L'eau de Javel contenant des atomes de chlore, on dit souvent par extension que de l'eau javellisée est « chlorée », terme qui est imprécis, car l'acide chlorhydrique est également une solution chlorée, et l'odeur caractéristique de l'eau de Javel n'a rien à voir avec l'odeur du dichlore.
Historique
Le chlore a été découvert en 1774 par le chimiste suédois Scheele. Claude-Louis Berthollet étudie quelques années après les propriétés décolorantes du chlore et en tire un procédé de blanchiment des toiles utilisant une solution de chlorure et d'hypochlorite de potassium : il vient d'inventer la « lessive de Berthollet », bientôt dénommée eau de Javel à la suite de la localisation de son premier site de production6 : la manufacture de produits chimiques construite en 1777 dans le village de Javel, au sud-ouest de Paris, qui donnera son nom au produit.
L'eau de Javel a rapidement connu un vif succès comme décolorant (auparavant, on devait exposer les toiles au soleil pendant des mois pour les blanchir ; la rosée du matin avait aussi ce pouvoir7).
En 1820, le pharmacien Antoine Germain Labarraque étudie les qualités désinfectantes des dérivés chlorés et des hypochlorites de potassium et de sodium. Il met au point une solution de chlorure et d'hypochlorite de sodium qu'il appelle « liqueur de Labarraque »8. En 1900, on appelait eau de Javel l'hypochlorite de potassium, et eau de Labarraque l'hypochlorite de sodium. Plus tard, le procédé de fabrication a remplacé le potassium par le sodium, sans changement de nom.
À partir du XIXe siècle, l'eau de Javel est couramment utilisée comme désinfectant et pour le traitement de l'eau potable (voir verdunisation).
Les chlorures décolorants, hypochlorites de sodium (eau de Javel) et de calcium (chlorure de chaux), ont été le premier débouché du chlore. Ils étaient obtenus par action du chlore sur les solutions de soude ou sur la chaux éteinte. Le chlore liquide a remplacé peu à peu le chlorure de chaux, qui est un mélange d'hypochlorite de calcium Ca(ClO)2 et de chlorure de calcium CaCl2 utilisé comme agent décolorant actif avant l'eau de Javel (jusqu'en 1925).
Présentation
L'eau de Javel se présente sous forme liquide (en bouteilles ou en berlingots) ou solide (en pastilles). Sous forme liquide diluée (bouteilles), elle se conserve trois ans[réf. souhaitée]. Sous forme concentrée (berlingots), elle ne se conserve pas plus de trois mois9. C'est pourquoi les berlingots doivent être dilués rapidement (à l'eau froide). Si ces délais sont dépassés, le produit ne désinfecte plus. L'eau de Javel doit par ailleurs être conservée à l'abri de la lumière et de la chaleur10.
Pour éviter les accidents, l'eau de Javel et les effluents en contenant sont stockés dans des emballages en matière plastique. L'INRS précise11 que le verre peut être utilisé, mais dans des bonbonnes protégées par une enveloppe métallique convenablement ajustée.
L'eau de Javel est commercialisée sous plusieurs niveaux de dilution. La quantité de chlore est exprimée en pourcentage de chlore actif (c.a.). Ce pourcentage représente la masse de dichlore formée à partir de 100 g d'eau de Javel. On trouve par exemple des bouteilles d'eau de Javel à 2,6 % de chlore actif et des berlingots d'eau de Javel concentrée à 4,8 % de chlore actif.
Le produit commercial change de nom en fonction de la dilution12 :
- extrait de Javel : produit contenant 9,6 % de chlore actif ;
- eau de Javel : produit contenant 2,6 % de chlore actif ;
- eau de Labarraque : eau de javel diluée.
Les pastilles d'eau de Javel sont en fait des pastilles de dichloroisocyanurate de sodium. Lorsqu'elles sont dissoutes dans l'eau, le dichloroisocyanurate de sodium réagit avec l'eau pour donner de l'hypochlorite de sodium et de l'acide cyanurique.
Aujourd'hui, l'eau de Javel est parfois incorporée dans des détergents pour proposer des produits « 2 en 1 » qui nettoient et désinfectent.
Utilisation
La javellisation est l'utilisation de l'eau de Javel essentiellement comme désinfectant.
L'eau de Javel désinfecte l'eau lors du traitement de l'eau potable. Le chlore a des propriétés rémanentes, ce qui signifie que son action désinfectante est valable sur tout le long du réseau de distribution d'eau.
L'eau de Javel peut être utilisée pour désinfecter les sanitaires, les sols, les éviers et les paillasses. Elle est parfois ajoutée à la lessive pour « blanchir » le linge.
Elle est également utilisée pour désinfecter l'eau des piscines, mais nécessite l'adjonction d'un réducteur de pH (souvent de l'acide sulfurique).
L'eau de Labarraque est le principal composant de la liqueur de Dakin, utilisée comme antiseptique.
Au-delà de l'utilisation comme désinfectant, l'eau de Javel peut être utilisée pour enlever des taches tenaces sur des vêtements en coton blanc.
L'eau de Javel concentrée (36° ou 9 %) est utilisée pour nettoyer les façades murales par élimination des dépôts verts : algues lichens, mousses.
Unités
L'unité officielle est la masse de dichlore produite par une masse donnée de solution, exprimée en % (% de chlore actif ou c.a.). Exemple : 1 g de dichlore produit par 100 g de solution.
Dans les pays francophone, on a utilisé jusqu'en 2001 le degré chlorométrique Gay Lussac, quantité de chlore gazeux, exprimée en litres, nécessaire pour obtenir un litre d’eau de javel13. Un degré chlorométrique correspond à 3,17 g de chlore libre par litre.
L'unité chimique est le nombre de moles de dichlore par litre ou kilogramme de solution.
Rappel : 1 ppm correspond à 1 mg/kg soit 0,001 g/kg, soit 0,000 1 g pour 100 g.
Effets sur la santé et l'environnement
Toxicologie (effets sur la santé)
L'eau de Javel est toxique et corrosive. Elle provoque des brûlures sur la peau, les muqueuses (les yeux notamment), surtout sous forme concentrée.
Son inhalation peut provoquer une réaction respiratoire (irritation bronchique, avec œdème dans les cas graves accompagné d'une baisse de la pression partielle de l'oxygène dans le sang) se manifestant par une dyspnée (manque de souffle, sensation d'étouffement) et une toux (qui peut persister plusieurs années)14.
Elle pourrait aussi affecter l'immunité chez les enfants qui sont régulièrement exposés à ses émanations. Une étude15 conduite sur la base d'un questionnaire aux parents de 9 102 enfants de six à douze ans en Espagne, Finlande et aux Pays-Bas, a en effet conclu que paradoxalement et contrairement à ce que laissent entendre les publicités, les infections ORL et respiratoires chez les enfants sont corrélées avec l'utilisation régulière comme nettoyant domestique de l'eau de javel dans leurs foyers : +20 % grippe en plus et +35 % d'amygdalite en plus (en tenant compte d'autres facteurs de risque tels que tabagisme passif, éducation parentale ou présence de spores de moisissures) ; selon les auteurs de l'étude, « les propriétés irritantes des composés générés par l'eau de javel peuvent endommager les parois des voies respiratoires favorisant l'infection de la flore locale. D'autre part, les produits ménagers à base de javel bloquent les réactions immunitaires de l'organisme »15. Selon l’INRS, l'hypochlorite de sodium inhibe l'activité des phagocytes chez la souris, mais non chez le rat et ce phénomène ne semble pas avoir été étudié chez l'Homme16.
Cette étude a aussi montré que la quantité d'eau de Javel utilisée comme désinfectant domestique varie beaucoup selon les pays (72 % des ménages en Espagne et 7 % en Finlande)15.
En outre, l'hypochlorite de sodium réagit avec les substances azotées, dont celles émises par l'homme dans les piscines (sueur et urine) comme elle peut réagir avec les protéines animales et végétales lors des opérations de désinfection de locaux ou des végétaux, ou dans les égouts ou bondes d'évier. Elle produit alors des dérivés chlorés dont certains sont susceptibles de dégazer dans l'air.
Les chloramines produites peuvent irriter les yeux.
Toxicocinétique et métabolisation
Les voies d'absorption classiques sont l'ingestion, le passage trans-cutané et l'inhalation.
Chez l'animal, l'ingestion orale induit un taux plasmatique maximal deux heures après (chez le rat à jeun, et après quatre heures chez un animal nourri).
Demi-vie : il faut 44 heures pour diviser par deux le taux sanguin chez le rat à jeun et 88,5 heures s'il est nourri.
Métabolisation : une solution aqueuse de [36CI]-hypochlorite de sodium est métabolisée par le rat en ions chlorure retrouvés (96 heures après en plus grande quantité dans le plasma), puis dans le sang total, mais aussi dans la moelle osseuse, les testicules, les reins et les poumons17.
Une heure seulement après ingestion d'hypochlorite de sodium, le plasma et le contenu intestinal de rats (nourris ou à jeun) contenaient de l'acide trichloroacétique, de l'acide dichloroacétique et du dichloroacétonitrile. Après 96 heures, 51,2 % de la dose initiale seulement était éliminée (à 36,4 % dans l'urine et 14,8 % dans les excréments). Après 120 heures, on trouvait encore chez ces rats des traces significatives du produit ([36CI]-hypochlorite de sodium).
Toxicité aiguë
La toxicité aiguë est d'abord liée au caractère corrosif de l'hypochlorite de sodium.
- DL50 orale : 5 800 mg/kg chez la souris ;
- DL50 cutanée : supérieure à 10 000 mg/kg chez le lapin ;
- CL50 par inhalation : supérieure à 10,5 mg/l pour une exposition d'une heure chez le rat.
Inhalation : chez la souris, la RD50 (dose induisant une diminution de 50 % de la fréquence respiratoire) est de 4,1 ppm pour une atmosphère d'hypochlorite mesurée en chlore libre (chiffre proche de la RD50 du chlore pur, 6,7 ppm).
Ingestion : des brûlures oropharyngées, œsophagiennes et gastriques sont constatées chez le chien pour 100 ml d'une solution à 5,25 %. Au-dessus de 5 ml/kg, des lésions corrosives apparaissent.
Exposition cutanée : elle induit un épaississement de la peau chez la souris (pour une solution à 1 g/l appliquée dix minutes par jour durant quatre jours). Les cellules basales de l'épiderme sont moins viables chez le cobaye (pour une solution à 0,5 % appliquée sur la peau durant deux semaines).
La peau du lapin est corrodée après quinze à trente minutes d'application d'une solution à 3,5 %. L'irritation augmente avec la dose.
Les muqueuses y sont naturellement plus sensibles ; chez le lapin, une solution à 0,5 % provoque une vive douleur sur l'œil, avec une irritation réversible en 24 heures. À 5 % on constate un obscurcissement passager de la cornée, un œdème de la conjonctive20, qui sont réversibles en 24 heures si l'œil a été rincé à l'eau dans les trente secondes (sinon, les lésions persistent une semaine). Chez le singe, la lésion — à dose identique — est plus rapidement réversible. À 15 %, la douleur est aiguë et — sans lavage oculaire immédiat — s'accompagne d'une hémorragie de la conjonctive et du nez, d'un œdème de la conjonctive. La cornée devient vitreuse, il y a un léger hématome ; la lésion est partiellement réversible en deux à trois semaines (séquelles).
Exposition chronique
Jusqu'à 4 000 mg/l, l'hypochlorite de sodium ingérée via l'eau de boisson n'influe pas sur la survie de rats, de souris (jusqu'à 2 754 mg/l) ou de cobaye (50 mg/l) expérimentalement exposés, mais des effets génotoxiques semblent possibles (démontrés chez la souris). Une étude montre aussi que les rats boivent moins d'eau quand elle est assez fortement javellisée, les plus jeunes grossissant légèrement21,18.
D'éventuels effets sur la fertilité sont discutés : il n'a été mesuré aucun effet chez le rat mâle ou femelle, mais chez la souris, à forte dose, l'hypochlorite de sodium induit des anomalies spermatiques (génotoxicité envisagée chez l'homme21,18). Des rats exposés durant deux mois et demi (avant et lors de la gestation) via 100 mg/l dans leur eau de boisson, ont produit des fœtus légèrement moins lourds, et présentent une légère augmentation d'anomalies (squelette et tissus mous). Cependant, une exposition sur sept générations n'a pas montré d'effet sur la croissance ni sur la survie.
Valeur limite
En 2006 (source INRS), aucun seuil n'avait été établi pour l'hypochlorite de sodium par l'Union Européenne, ni par la France (ministère chargé du Travail), ni par les États-Unis (ACGIH) ni par l'Allemagne (MAK).
Écotoxicologie
L'eau de Javel est un puissant biocide nécessitant des précautions pour sa manipulation et pour éviter les rejets de ce produit dans la nature. Les eaux javellisées et extraits concentrés de Javel oxydent la matière organique qu'elles rencontrent en étant susceptible de produire des organochlorés toxiques et de nombreux produits de dégradation (chlorures) et métabolites lorsqu'elle a été ingérée par des animaux ou autres organismes aquatiques. L'effet toxique sur la faune est donc persistant en se transmettant via la chaîne alimentaire. Ces transformations seraient cancérogènes et mutagènes22. L'eau de Javel, au contact de l'air, se décompose lentement (à température ambiante, plus rapidement au soleil et/ou exposée à la chaleur, ou en contact avec des métaux) en formant des chlorates et du chlorure de sodium, en libérant du dioxygène selon les réactions :
De nombreux métaux (dont le cuivre (souvent utilisé pour les tuyauteries), le nickel et leurs alliages) peuvent avoir un effet catalytique et accélérer la décomposition de l'eau de Javel.
L'eau de Javel utilisée pour la désinfection des sols ou des WC est présente via les effluents domestiques des bâtiments tertiaires ou industriels dans les égouts et dans certaines stations d'épuration, où elle perd rapidement son pouvoir oxydant en raison de la grande quantité de matière oxydable qui y est présente, mais elle pourrait contribuer à y sélectionner des organismes chlororésistants ou produire des métabolites indésirables.
En raison de son action corrosive et super-oxydante, tout rejet accidentel ou chronique direct en milieu naturel peut avoir des conséquences écotoxicologiques locales (Le plancton est par exemple très sensible à de faibles doses de chlore). L'incinération de matières organiques contenant de l'eau de Javel active devrait être évitée en raison du risque de production d'organochlorés stables tels que furanes et dioxines.
Précautions d'emploi
En cas de projection, rincer longuement et abondamment à l'eau claire.
Les accidents les plus fréquents sont liés à l'ingestion volontaire (tentative de suicide) ou involontaire et aux mélanges avec d'autres produits (elle doit surtout ne pas être mélangée aux acides, qui provoquent un violent dégagement gazeux de dichlore, très toxique.)
Les pastilles doivent être tenues hors de portée des enfants parce qu'elles risquent d'être confondues avec des bonbons.
L'eau de Javel doit être conservée en emballage opaque et au frais, car les ions hypochlorite sont dégradés par les UV solaires et la chaleur. Elle ne doit pas être mélangée à de l'eau chaude, ni mélangée à d'autres biocides ou agents nettoyants (émanations toxiques possibles). Combinée à l'ammoniaque (présent dans certains produits de nettoyage), elle produit des chloramines (avec éventuel dégagement d'azote). Combinée à des acides, par exemple des acides chlorhydrique ou sulfurique ou même des acides doux présents dans certains produits de nettoyage ou décapants, elle réagit violemment en émettant de la vapeur de dichlore, très toxique (du vinaigre ou du jus de citron suffisent à produire ce type de réaction).
L'INRS rapporte aussi qu'appliqué sur des matériaux finement divisés (fibres textiles, papier ou poussière de bois), l'extrait de Javel peut dégager de la vapeur d'eau contenant un peu de chlore, ces matériaux devenant ensuite plus inflammables à l'état sec.
Pour la désinfection des surfaces, elle doit être correctement diluée et uniquement utilisée après nettoyage complet par un détergent suivi d'un rinçage, pour une désinfection efficace et pour ne pas favoriser l'apparition du phénomène de résistance au chlore chez certains microbes et parasites, dont les cryptosporidies (et notamment Cryptosporidium parvum, parasite (protozoaire) qui peut se développer dans les piscines et qui développe rapidement des résistances à de nombreux biocides).
Certaines bactéries se sont montrées également capables après phénomène de sélection naturelle de développer des résistances à des concentrations importantes de chlore. Des tapis de bactéries dites chlororésistantes ont ainsi été trouvés dans l'Aa durant plusieurs années, sur plusieurs kilomètres, à la suite de l'usage de quantités importantes de désinfectants chlorés dans le processus d'une usine riveraine de la rivière.
L'eau de Javel ne doit pas être employée pour nettoyer des ustensiles en aluminium, inox ou argent, qu'elle noircit.
Pour être efficace, une dose ouverte doit être rapidement utilisée, et il convient de respecter la date limite d'utilisation du produit.
Composition
L'hypochlorite de sodium NaClO est un sel de sodium de l'acide hypochloreux HClO. En solution, l'hypochlorite de sodium NaClO se décompose en ions sodium Na+ et hypochlorite ClO−.
HClO est un acide faible dont la base conjuguée est l'ion hypochlorite ClO−. L'équilibre acido-basique du couple HClO / ClO− s'écrit :
La composition de l'eau de Javel dépend du pH, selon les deux équilibres chimiques suivants :
Propriétés
Propriétés désinfectantes
Ce biocide a un large spectre désinfectant. Grâce à son pouvoir oxydant, il est :
- Bactéricide (bactéries à Gram positif et Gram négatif) ;
- Sporicide ;
- Fongicide ;
- Virucide (hépatite et VIH (virus de l'immunodéficience humaine)).
Remarque : en réponse à une infection, le système immunitaire humain peut produire un oxydant fort, l'acide hypochloreux, générée dans les neutrophiles activés par peroxydation myéloperoxydase médiée par des ions chlorure, qui contribue à la destruction des bactéries23,24,25.
Cependant, l'eau de Javel n'est pas un détergent, et ne lave donc pas ; pour désinfecter une surface, il faut d'abord la nettoyer avec un détergent, avant d'appliquer l'eau de Javel sur la surface propre.
L'eau de Javel permet de tuer les bactéries et autres microbes qui entrent en contact avec elle ou avec certains de ses sous-produits (chlore gazeux). Pour cela, il faut que les microbes ne soient pas protégés dans un biofilm, dans un autre organisme qui ferait écran, ou dans un épais mucus.
L'eau de Javel peut être utilisée pour le traitement de l'eau potable. Pour être totalement efficace, l'eau de Javel doit agir au moins un quart d'heure. L'eau de Javel doit toujours être utilisée avec de l'eau froide, car outre que la dilution à l'eau chaude est dangereuse, elle diminue fortement les propriétés désinfectantes de l'eau de Javel.
Réaction avec les acides
Dans l'eau de Javel mise en contact avec un acide, c'est-à-dire des ions H+, l'équilibre chimique (2) va être déplacé vers la droite. La réaction suivante va se produire :
Il se produit alors un dégagement de dichlore qui est un gaz très toxique. C'est pour cela que l'eau de Javel ne doit jamais être en contact avec des acides, que l'on trouve par exemple dans les produits détartrants ou dans l'urine.
Réaction avec l'ammoniac
Lorsqu'ils sont mis en présence, l'acide hypochloreux (HClO) et l'ammoniac (NH3) donnent des chloramines selon les réactions suivantes :
puis :
et ensuite :
Les chloramines gazeuses sont très irritantes. C'est pour cela qu'il ne faut pas mélanger l'eau de Javel avec de l'ammoniaque.
C'est la même réaction qui a lieu lorsqu'un nageur urine dans l'eau d'une piscine désinfectée au chlore. C'est aussi la raison pour laquelle il ne faut pas nettoyer une litière d'un animal domestique avec de l'eau de Javel. L'urée contenue dans l'urine est un produit azoté. Il va donc se former des chloramines irritantes pour les muqueuses et les yeux.
Propriétés oxydantes
L'eau de Javel a des propriétés oxydantes dues à l'ion hypochlorite ClO−. L'ion ClO− est un oxydant puissant. De ce fait, le degré d'oxydation du chlore est +1 dans HClO pour devenir –1 dans Cl−. La demi-réaction redox s'écrit :
Comme exemple de réaction redox avec le HClO, voici un exemple en électrochimie :
« Soit l'équation suivante qui décrit la réaction se déroulant dans une pile électrochimique » :
Les demi-réactions redox sont :
On peut conclure que cette réaction peut aisément faire fonctionner une pile électrochimique avec le réactif chromé comme électrode positive et le réactif chloré comme électrode négative.
Cet agent actif est à l'origine du pouvoir blanchissant de l'eau de Javel. L'ion Cl− est son réducteur conjugué. On définit le couple redox ClO− / Cl−. La réaction de réduction de l'ion hypochlorite ClO− s'écrit :
La décomposition de l'eau de Javel en ion hypochlorite et acide hypochloreux dépend fortement du pH du milieu : à des pH supérieurs à 8, l'eau de Javel perd de son activité désinfectante car elle ne libère plus que 25 % (environ) d'ion biocide ClO−. Il faut alors avoir recours à un complément, le brome par exemple.
Notes et références
- HYPOCHLORITE DE SODIUM (SOLUTION, CHLORE ACTIF =5%) [archive] et HYPOCHLORITE DE SODIUM (SOLUTION, CHLORE ACTIF >5%) [archive], Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 » [archive], sur www.chem.qmul.ac.uk.
- Au XVIIIe et jusqu'au XXe siècle, le quartier de Javel est parfois graphié « Javelle », voir carte de Cassini [archive].
- « Gervaise, sans retrousser ses jupes, en femme habituée aux flaques, s'engagea sous la porte, encombrée de jarres d'eau de javelle » (Zola, Assommoir, 1877, p. 386). « Elle porte un paquet de linge mouillé sur l'épaule droite et un seau avec battoir, eau de javelle, etc. » (Frapié, Maternelle, 1904, p. 234).
- Eau de javel [archive], Société chimique de France : « En conséquence, le pH d'une eau de Javel est basique (11,5 < pH < 12,5) ».
- Jean-Noël Joffin, « Hypochlorites et eaux de Javel : unités de concentration, préparation des solutions désinfectantes », Opéron XXI, no 2, , p. 2 (lire en ligne [archive] [PDF]), version du (remaniée par Pierre Gandolfi et relue par Claudine Schuster).
- Rédaction de Parlons peu parlons Science, « La Lune, une croqueuse de couleurs » [archive], sur parlonspeuparlonscience.com, (consulté le ).
- « L'eau de Javel fête ses 200 ans », Le Monde, (lire en ligne [archive] [PDF]), p. 16 du fichier.
- « Conservation de l’eau de Javel » [archive], sur hygieneconseils.com (consulté le ).
- « Précautions d'emploi » [archive], sur eaudejavel.fr.
- Voir fiche toxicologique déjà citée dans les notes et références de cette page.
- « Eaux et extraits de Javel, Hypochlorite de sodium en solution (FT 157). Caractéristiques - Fiche toxicologique » [archive], sur inrs.fr, (consulté le ).
- « Table de correspondance » [archive], sur spc.ac-aix-marseille.fr (consulté le ).
- intracto, « Eau de Javel » [archive], sur Centre Antipoisons Belge (consulté le )
- (en) Casas, L., Espinosa, A., Borràs-Santos, A., Jacobs, J., Krop, E., Heederik, D., … et Zock, J. P., Domestic use of bleach and infections in children: a multicentre cross-sectional study, Occupational and Environmental Medicine, 2014 (résumé [archive]).
- Des chercheurs belges ont cherché à établir l'existence d'un lien entre l'utilisation de l'eau de javel à des fins domestiques et la fréquence d'infections ORL et pulmonaires chez les enfants entre 6 et 12 ans [archive], Science et Avenir, .
- (en) « Report of an expert panel – Interpretive review of potential adverse effects of chlorinated organic chemicals on human health and environment », chap. 2 : « Chlorine », Regulatory Toxicology and Pharmacology, 1994, 20, 1, 2e partie, p. S69-S125.
- (en) « Sodium hypochlorite », dans base de données IUCLID, Ispra, CEC, ECB, Environment Institute, 1995.
- (en) « Sodium hypochlorite », dans base de données ChemInfo, Hamilton, Centre canadien d'hygiène et de sécurité, 1999, no 351.
- (en) « Sodium hypochlorite », dans base de données HSDB, Hamilton, Centre canadien d'hygiène et de sécurité, 1999.
- (en) IARC Monographs on the evaluation of carcinogenic risks of chemicals to humans – Hypochlorite salts –, dans Chlorinated drinking-water; Chlorination by-products; some other halogenated compounds; cobalt and cobalt compounds. Lyon, CIRC/IARC (Centre international de recherche sur le cancer), 1991, vol. 52, p. 159-176.
- Article sur l'eau de Javel [archive], Raffa.
- (en) Harrison, J. E. et J. Schultz, Studies on the chlorinating activity of myeloperoxidase, Journal of Biological Chemistry, 1976, vol. 251, p. 1371-1374.
- (en) Thomas, E. L., Myeloperoxidase, hydrogen peroxide, chloride antimicrobial system: Nitrogen-chlorine derivatives of bacterial components in bactericidal action against Escherichia coli, Infect. Immun., 1979, 23:522-531.
- (en) Albrich, J. M., C. A. McCarthy et J. K. Hurst, Biological reactivity of hypochlorous acid: Implications for microbicidal mechanisms of leukocyte myeloperoxidase, Proc. Natl. Acad. Sci., États-Unis, 1981, 78:210-214.
Voir aussi
Articles connexes
- Chlore
- Désinfectant, Biocide
- Résistances (d'organismes vivant)
- Eau de Dakin (eau de javel à usage médical)
Liens externes
- Fiche toxicologique [archive], INRS, 2006.
- L'eau de Javel [archive], Société chimique de France.
- Chambre syndicale nationale de l'eau de Javel [archive] (CSNEJ).
Ajax (marque)
Ajax est une marque de produits ménagers appartenant au groupe Colgate-Palmolive. Depuis de nombreuses années[Quand ?], le produit n'a pas changé de logo. Divers produits nettoyants existent sous la marque Ajax. La plupart sous forme liquide, mais aussi sous forme de crème ou de poudre.
Références
Gel douche
Un gel douche est une préparation liquide utilisée pour nettoyer le corps lors des douches et bains, dont l'objectif est semblable à celui du savon mais présenté sous forme liquide. Ils ne doivent pas être confondus avec les savons liquides car ils ne contiennent pas d'huile saponifiée. A la place, ils contiennent des détergents tensioactifs synthétiques dérivés soit du pétrole, soit de plantes.
Les deux composants principaux des gels douche sont l'eau (80-90 %), suivi des tensioactifs (5-15 %). Ils ne contiennent pas de savon1. Pour le reste (environ 5 %) on trouve des actifs apaisants, parfums, colorants, agents de texture et des conservateurs indispensables pour limiter la prolifération bactérienne dans ce produit liquide1. Les gels douche ont une valeur de pH neutre, plus faible que celui du savon traditionnel, ce qui assèche moins la peau. Il convient de vérifier si le gel douche contient des ingrédients réputés toxiques, irritants ou allergisants1,2.
Les agents lavants du gel douche dits « de surface » sont de bons agents moussants. Ils produisent une mousse abondante. Ils sont également de bons émulsifiants qui favorisent la stabilité du mélange. Leur propriété détergentes vont lessiver les lipides de la peau (film hydrolipidique), parfois trop, au point de décaper à l’excès l’épiderme1.
Comme tous les produits cosmétiques les gels douche commercialisés dans l'Union européenne doivent répondre à la norme européenne de 2009, régulièrement modifiée3 transposée dans la loi et la réglementation française4,5.
L'Union fédérale des consommateurs-Que Choisir tient à jour un dossier relatif aux ingrédients indésirables dans les cosmétiques. Au un total de 9 978 gels douche différents, présents sur le marché français ont fait l'objet d'une évaluation selon cinq niveaux de risques pour quatre catégories d'usagers différentes1,6.
Références
- Que Choisir, Décrypter les produits du quotidien, Luçon, Que Choisir, , 315 p. (ISBN 979-10-93588-12-4), p 129
- Christine Riste, « Derrière l’étiquette: le gel douche » [archive], sur Le Particulier – Le Figaro, (consulté le ).
- « Règlement (CE) n°1223/2009 du Parlement européen et du Conseil du 30 novembre 2009 relatif aux produits cosmétiques (modifiés) » [archive], (consulté le ).
- « Loi n°2014-201 du 24 février 2014 portant diverses dispositions d'adaptation au droit de l'Union européenne dans le domaine de la santé » [archive] (consulté le ).
- « Surveillance du marché des produits cosmétiques : /Réglementation des produits cosmétiques » [archive] (consulté le ).
- « Comparatif Substances toxiques dans les cosmétiques : Gels douche (Soins du corps) » [archive], sur Que choisir (consulté le ).
Shampooing
Le shampooing ou shampoing1 est un produit cosmétique présenté généralement sous forme de liquide, crème, solide ou poudre, formulé à partir de substances tensioactives permettant de nettoyer la chevelure et éventuellement de traiter le cheveu.
Outre la présence de produits chimiques avérés ou suspectés néfastes pour l'environnement, il a été montré que l'utilisation trop fréquente de shampooing a une action décapante sur le sébum, huile naturellement produite par le cuir chevelu.
Étymologie et origine
Le mot shampoo date en anglais de 1762, où il avait le sens de « masser ». Le mot était emprunté à l'anglo-indien shampoo, qui venait à son tour du hindi chāmpo (चाँपो /tʃãːpoː/), l'impératif de chāmpnā (चाँपना /tʃãːpnaː/), « huiler, masser les muscles », et qui était dérivé lui-même du mot sanskrit / hindi chāmpnā (चाँपना /tʃãːpnaː/), désignant les fleurs de la plante Michelia champaca (famille des Magnoliaceae) traditionnellement utilisées pour faire des huiles odorantes pour cheveux. Les Indiens s'en servaient pour s'enduire les cheveux et les faire briller.
Kasey Hebert fut le premier producteur connu de shampooing et c'est à lui qu'on en attribue actuellement l'origine. Il vendait son premier shampooing, « Shaempoo » dans les rues de Londres, sa ville natale.
Le terme et le service ont été présentés par Sake Dean Mahomed (en), né à Patna en Inde, qui ouvrit à Brighton en 1814 un bain shampooinant sous le nom de Bains de vapeur indiens de Mahomed2. Ses bains ressemblaient à des bains turcs où les clients recevaient un traitement indien de champi, c'est-à-dire de shampooing, ou des massages thérapeutiques. Son service fut apprécié ; il reçut cette haute distinction d'être fait chirurgien shampouineur de George IV comme de Guillaume IV.
Utilité
La peau est un organe très important qui est chargé de laisser passer la transpiration, tout en empêchant les corps étrangers de pénétrer dans l'organisme. Ces corps étrangers incluent poussières, microbes et molécules toxiques. Le corps étant constitué à 80 % d'eau, la peau doit se prémunir du dessèchement (qui se traduit par des gerçures voire des crevasses). C'est pour cela que la sueur s'accompagne d'une sécrétion d'un corps gras : le sébum. Il permet donc à la peau de maintenir son taux d'humidité, et donc de rester douce, souple et intègre. Malheureusement, comme tout corps gras, le sébum a tendance à s'imprégner des corps étrangers en contact avec la peau. S'il n'est pas évacué, il se forme à la surface de la peau une couche épaisse et noirâtre de sébum mélangé de poussières, de bactéries et de substances plus ou moins toxiques : c'est la crasse. Devenir crasseux pose des problèmes d'hygiène (multiplication des bactéries et odeurs associées), et de salissures des vêtements (cf. cols de chemises).
Au niveau du cuir chevelu, le sébum protège également les cheveux en enduisant les écailles et surtout l'espace entre les écailles d'un film protecteur. Ce film a deux intérêts :
- protection mécanique contre les poussières ;
- protection chimique contre l'oxygène de l'air qui va dégrader les écailles, et contre la déshydratation (cheveu sec).
Au fil des jours, le sébum va s'accumuler dans les cheveux, surtout dans les parties proches du cuir chevelu. Les mouvements des cheveux contribuent également à l'étalement de ce sébum. Plus la quantité de sébum augmente, plus le film devient épais. Les cheveux deviennent « gras » et ont tendance à se coller entre eux, s'alourdir, donnant un effet « mouillé » inesthétique. Selon les profils de peau, la production de sébum est plus ou moins abondante.
Utilisation
Shampooing lavant à base de détergent
Le lavage de base se fait à l'eau (solvant). Mais l'eau seule ne se mélangeant pas avec un corps gras, il est nécessaire d'y ajouter un agent dispersant (détergeant), lui permettant de dissoudre le sébum (et les saletés incrustées) des cheveux et du cuir chevelu. Le shampooing s'applique en massant sur les cheveux mouillés, ce qui permet d'augmenter mécaniquement l'efficacité du lavage. On masse le cuir chevelu sans trop frotter les cheveux. Il est inutile d'attendre qu'il agisse et il est déconseillé de faire 2 lavages successifs car l'agression du second lavage sera beaucoup plus forte. Pour faciliter le lavage, il est recommandé d'utiliser de l'eau chaude (augmentation du pouvoir solvant de l'eau), cependant, la chaleur dilatant les pores et stimulant les glandes sébacées, le cuir chevelu peut répondre en produisant davantage de sébum.
Il faut rincer abondamment pour limiter les résidus de shampooing dans les cheveux.
La fréquence normale du lavage des cheveux devrait-être tous les 2 à 3 jours. Pour les cheveux secs ou longs, les lavages devront être espacés (1 fois par semaine), tandis que pour les cheveux gras, augmenter la fréquence risque de stresser davantage le cuir chevelu qui va graisser encore plus vite.3
Inconvénients
Le lavage a deux conséquences : assécher le cheveu et irriter le cuir chevelu.
Le problème de la peau, c'est qu'elle est elle-même constituée de cellules dont la paroi est constituée de lipides. Pour faire une image, si on schématise à l'extrême, nos cellules sont littéralement des bulles de graisses contenant de l'eau. Toute la difficulté réside alors dans la capacité du détergeant à dissoudre le sébum sans dissoudre la paroi cellulaire. Actuellement[Quand ?] aucun détergent n'est parfaitement sélectif. C'est pourquoi tous les détergents des shampooings sont dits irritants : ils altèrent les cellules de l'épiderme en créant des irritations (destruction de cellules ou désolidarisation de cellules) qui deviennent des brèches notamment pour les différents produits chimiques en contact avec la peau. Le rôle du fabricant de shampooing lavant à base de détergent va être de trouver un produit peu irritant, puis de lui ajouter des agents permettant de limiter les potentielles irritations.
C'est pourquoi également, tous les shampooings sont porteur de règles de sécurités en cas de réaction allergiques ou de projection dans les yeux. Il est aussi recommandé de changer régulièrement de marque de shampooing pour varier les produits appliqués et limiter la sensibilisation du cuir chevelu.
Si on enlève trop régulièrement le sébum par des shampooings, le cuir chevelu va se dessécher, conduisant souvent ce dernier à augmenter la production de sébum pour compenser. Outre la présence de produits chimiques avérés ou suspectés néfastes pour l'environnement, il a été montré que l'utilisation fréquente de shampooing a une action décapante sur le sébum, huile naturellement produite par le cuir chevelu. Ceci conduit à une sur-activation des glandes sébacées, ce qui graisse alors plus rapidement les racines des cheveux. Selon Michelle Hanjani, une dermatologue de l'université Columbia, une diminution graduelle de l'utilisation du shampooing permettrait de faire diminuer progressivement la production de sébum et réduirait donc l'aspect graisseux du cuir chevelu4.
Soins complémentaires
Le shampooing est souvent l'étape principale du traitement du cheveu. Il en existe d'autres, complémentaires ou à visées esthétiques :
- l'avant-shampooing : très utilisé en Asie, l'avant shampooing est un masque destiné à être appliqué sur cheveux secs (avant le shampooing) et potentiellement abîmés, avec les écailles un peu ouvertes. Les principes sont les mêmes que pour le masque, sauf que le produit est plus liquide et pénètre plus profondément. L'avant-shampooing peut permettre aussi de préparer le cheveu au lavage et à ses produits agressifs ;
- l'après-shampooing ou « conditionneur » (terminologie anglo-saxonne) : les après-shampooings sont des shampooings… sans shampooing : les agents lavants sont beaucoup moins présents et beaucoup moins agressifs. L'après-shampooing doit cependant être rincé. Son rôle est de procurer un traitement superficiel :
- l'absence de détergents permet aux corps gras (huiles) et aux différents produits actifs d'être plus efficaces,
- l'après shampooing peut n'être appliqué que sur les pointes, notamment pour graisser celle-ci sans sur-graisser les racines, qui le sont déjà grâce au sébum naturel),
- l'après shampooing permet de faciliter le coiffage et la tenue de la coiffure (souvent grâce à des silicones),
- les additifs de l'après shampooing sont proches du shampooing (ou en complément). Il existe donc un type d'après shampooing spécifique à chaque type de cheveu,
- en cas de lavages répétés et fréquents (tous les jours), l'après-shampooing seul peut être envisagé car moins agressif, et le cheveu potentiellement moins sale ;
- le masque ne contient aucun détergent et a pour seul but de nourrir et réhydrater le cheveu en profondeur. Il doit pour cela être appliqué pendant au moins trente minutes. Il ne répare pas le cheveu, mais ralentit sa dégradation (cas des cheveux fragiles, ou abîmés). Il doit être rincé après ;
Autres shampooings
Bien que cette approche paraisse peu attirante dans un premier temps, de plus en plus de personnes tentent l'expérience en utilisant d'autres techniques de lavage5 :
- Les shampooings secs se présentent sous la forme d'une poudre pulvérisée en aérosol sur les cheveux. Cette poudre absorbe l'excès de sébum et est ensuite évacuée en brossant la chevelure6. Ces shampooings contribuent à rafraîchir l'aspect des cheveux, ce qui permet d'espacer les lavages. Cela devient particulièrement utile pour les cheveux longs, ou l'application sur les racines permet d'éliminer l'excès de sébum tout en préservant les pointes.
- Les produits traditionnels comme le bicarbonate de soude, le vinaigre de cidre, les poudres lavantes, les œufs, etc.
Adaptation aux types de cheveux
Selon les types de cheveux, certaines formulations sont déconseillées et d'autres conseillées. Les informations donnés ici sont à titre indicatif et peuvent être combinées.
Cheveux normaux
Les cheveux normaux sont sains, brillants, sans fourches ou cassures. Les shampooings pour cheveux normaux sont censés être les plus neutres au niveau de la formulation.
Cheveux secs
Les cheveux sont secs car ils ne sont pas assez graissés par le sébum. Trois facteurs peuvent expliquer cela :
- sécrétion de sébum insuffisante ;
- couche de silicone laissée par les précédents shampooings empêchant le sébum de faire efficacement son effet de graissage ;
- cheveux trop longs (le sébum n'arrive pas jusqu'aux pointes.
Les shampooings pour cheveux secs contiendront donc :
- moins de silicones ;
- moins d'alcools et de solvants volatils (qui contribuent à assécher le cheveu) ;
- plus de corps gras ;
- plus d'agents hydratants.
Cependant, l'effet naturellement détergeant du shampooing nécessitera d'appliquer un soin de graissage sous forme de masque pour plus d'efficacité. Ceci est d'autant plus vrai pour les cheveux ondulés et crépus (le masque gras est indispensable).
Cheveux fragiles ou abîmés
Les cheveux fragiles ou abîmés (fourches, cassures, etc.) sont souvent ternes. Les deux causes de cette fragilité sont :
- cheveux longs et donc moins graissés par le sébum, voire plus graissés du tout et soumis aux agressions extérieures ;
- cheveux souvent traités à la chaleur (séchage ou fer) ou avec des produits agressifs notamment lors de colorations.
Ces cheveux vont avoir besoin d'une armure de protection qui va les protéger et les lisser. Actuellement[Quand ?] les shampooings les plus efficaces utilisent des formulations à base de silicone et de corps gras, qui va les protéger plus efficacement.
Attention, malgré les formules marketing, il n'existe pas de shampooing réparateur. Toute partie du cheveu endommagée le restera jusqu'à sa coupe. Le but du shampooing est de colmater les brèches (avec du silicone essentiellement).
Cheveux frisés
Les cheveux frisés nécessitent des soins particuliers afin d'entretenir leur volume et leur boucle. L'humidité joue un rôle important dans l'hygiène des chevelures bouclées. Les shampooings dédiés évitent donc le silicone, qui contribue à faire perdre leur naturel aux cheveux bouclés en empêchant leur hydratation naturelle.
Cheveux fins
Les cheveux fins une fois lavés créent souvent un effet « manque de volume ». En effet les cheveux en se frottant créent naturellement de l'électricité statique (charges négatives), lors du shampooing, les tensioactifs anioniques vont neutraliser ces charges négatives et les cheveux vont moins se repousser, d'où la perte de volume. La solution est donc de rajouter les agents chargés négativement (notamment sous la forme d'agents cationiques), pour recréer du volume. Les cheveux fins ont également une tendance à se dessécher plus vite, d'où une formulation des shampooings moins intense en silicone. Une autre raison est que le silicone en excès peut alourdir le cheveu, et particulièrement les cheveux fins.
Cheveux gras
Les cheveux gras sont souvent la conséquence d'un excès de sébum. Les shampooings pour cheveux gras auront donc des agents détergents plus puissants (pour éliminer la graisse). Cependant, ces shampooings ont tendance à irriter et dessécher le cuir chevelu… qui va avoir tendance à sécréter encore plus de sébum (cercle vicieux). Ces shampooings vont éviter d'utiliser du silicone (qui empêche le sébum de pénétrer contribuant à rendre le cheveu plus gras).
Cheveux colorés
Les cheveux colorés ont tendance à se ternir (oxydation de la couleur), et ses écailles ont tendance à s'ouvrir (affaiblissant le cheveu et augmentant l'oxydation). Il est donc nécessaire d'avoir un soin qui va :
- refermer les écailles : c'est souvent en utilisant un tensioactif cationique (qui agit également en tant que démêlant !) ;
- protéger le cheveu de l'oxydation grâce à des agents antioxydants (vitamine E par exemple), et avec du silicone formulé pour faire écran aux molécules d'oxygène (oxydantes). Cependant le silicone va pénaliser la prochaine coloration s'il n'est pas totalement enlevé ;
- éviter d'utiliser du sulfate (qui a tendance à ternir le cheveu) dans les tensioactifs, surtout si la couleur est fragile et les lavages fréquents. Cependant, les autres agents lavants sont souvent moins efficaces ;
- limiter l'impact des UV (colorants anti-UV) ;
- éliminer le calcaire qui a tendance à se déposer entre les écailles. La meilleure solution est d'utiliser un acide (acide citrique par exemple). L'acide va également resserrer les écailles du cheveu.
Pellicules
En cas de pellicules, deux causes peuvent exister :
- un shampooing trop agressif (ou une peau trop sensible). Il faut donc dans ce cas privilégier les shampooings ne contenant pas (ou peu) d'agents anioniques ;
- des champignons cutanés. Il faut dans ce cas utiliser un shampooing antifongique spécifique : le shampooing antipelliculaire (souvent à base de pyrithione de zinc).
Poux
Les shampooings anti-poux font partie des solutions médicamenteuses permettant de lutter contre la pédiculose du cuir chevelu.
Pour les animaux
Pour les animaux de compagnie ou de concours, des shampooings spécifiques évitent notamment des irritations et plaques rouges. En effet, la peau des chiens et chats a un pH différent de la peau humaine.
Ingrédients
Histoire
Dans l'Égypte antique, le shampoing était fait d'acide citrique, un peu de savon et de l'eau7.
Des temps anciens à ce jour, les Indiens ont utilisé différentes formules de shampooings en se servant de plantes comme le neem, l'acacia Concinna ou la noix de lavage, le henné, le bael, la bacopa monnieri, le fenugrec, le babeurre, l'amla, l'aloès et l'amande en combinaison avec quelques composantes aromatiques comme le santal, le jasmin, le curcuma, la rose et le musc.
Dans les premiers temps du shampooing, les coiffeurs anglais faisaient bouillir des paillettes de savon dans de l'eau avec des plantes afin de donner lustre et fragrance aux cheveux.
À l'origine, les premiers shampooings étaient à base de savon noir et de cristaux de soude ; tous deux contiennent des tensioactifs (détersifs). Ils laissaient souvent un dépôt blanchâtre. Les cheveux pouvaient rapidement devenir poisseux et emmêlés. Il faudra attendre le shampooing moderne, celui que nous connaissons aujourd'hui, pour régler ces problèmes. Une formule améliorée a d'abord été proposée au cours des années 1930 avec Drene, le premier shampooing synthétique (et non-savonneux). Puis, Eugène Schueller, de L'Oréal lance en 1931 un shampooing à base de matières synthétiques, le Platinosel, qui laisse les cheveux propres et soyeux. En 1934, c'est au tour de Dop, premier shampooing grand public8.
Shampooings professionnels
Les shampooings professionnels diffèrent peu des shampooings grand public. Ils possèdent quelques atouts cependant :
- ce sont les premiers à utiliser les nouvelles molécules ;
- ils sont plus sélectifs dans leur formulation et avec davantage de formation, les coiffeurs ont alors la charge de bien analyser le cheveu pour éviter de dégrader ce dernier avec un shampooing non adapté ;
- ils peuvent être plus agressifs, pour éliminer la laque ou d'autres produits coiffants et doivent être rincés rapidement et consciencieusement.
Additifs liés au marketing
Aux agents détergents, le fabricant va ajouter des éléments de conservation (pour éviter que le shampooing ne se dégrade), et des agents « commerciaux », non liés directement au shampooing mais facilitant sa vente (colorants, parfums, texture , etc.).
Les agents détergents utilisés ont une mousse éphémère, il leur est fréquemment ajouté des agents moussants (détergents peu efficaces mais moussant beaucoup) pour que la mousse soit plus généreuse et surtout plus persistante.
Composition des shampooings modernes
La composition des shampooings suit le format définit par l'International Nomenclature of Cosmetic Ingredients (INCI)9.
De nos jours[Quand ?], un shampooing contient :
- de l'eau (Aqua) déminéralisée, en tant que solvant (40 à 60 % de la formulation) et agent liquéfiant ;
- des agents lavants (15 à 30 %), qui dissolvent la graisse qui est entraînée dans l'eau avec les molécules ou particules qu'elle a fixé ;
- des anioniques (détergents efficaces notamment sur les zones graisseuses et oxydées, leur mousse est légère et éphémère. Ils sont légèrement irritants) :
- du laureth sulfate de sodium (sodium laureth sulfate, SLES) (le plus commun)
- du sodium pareth sulfate
- du laurylsulfate d'ammonium (ammonium lauryl sulfate, ALS) (moins irritant que le laureth sulfate de sodium, utilisé notamment pour les cheveux colorés)
- du laureth sulfate d'ammonium (ammonium laureth sulfate) (moins irritant que le laureth sulfate de sodium)
- cocosulfate de sodium
- du laurylsulfate de sodium (sodium lauryl sulfate, SDS) (ce dernier étant le plus agressif et devant être bien rincé)
- du disodium laureth sulfosuccinate (haute tolérance cutanée + moussant et viscosant)
- du diéthanolamine (DEA)
- du triéthanolamine (TEA)
- de Lauryl alcphol, dodécanol (détergents moins irritants)
- du glutamate
- des cationiques (action démêlante et adoucissante) :
- Polyquaternium
- Guar Hydroxypropyltrimonium chloride
- des non-inoniques (surfactants souvent d'origine naturelle particulièrement doux contrecarrant le côté irritant des agents anioniques)
- des glucosides et dérivés
- cocamides (moussant et épaississant), ils sont souvent utilisés pour atténuer le côté irritant des tensioactifs anioniques
- bétaïnes (moussants) souvent dérivés de la noix de coco
- poloxamère
- des anioniques (détergents efficaces notamment sur les zones graisseuses et oxydées, leur mousse est légère et éphémère. Ils sont légèrement irritants) :
- des agents moussants (qui sont également des tensioactifs) :
- des agents conservateurs (biocides conservateurs obligatoires pour prolonger la durée de conservation du produit et limiter la prolifération bactérienne) :
- Formaldéhyde (interdit de nos jours en Europe, sauf dans les vernis à ongles)
- Alcools légers
- Alcohl, Ethyl alcohol, x-prop-x-ol, x-prop-x-yl (risque de dessèchement du cheveu si la quantité est trop importante)
- Benzyl alcohol (non desséchants)
- éthers de glycol
- parabènes (non irritants mais potentiellement cancérogènes pour les femmes)
- Methylparaben
- Propylparaben
- Les isothiazolinones (irritants) :
- Methylchloroisothiazolinone
- Méthylisothiazolinone
- Conservateurs « doux »
- des agents émulsifiants (qui évitent de devoir remélanger le shampooing dont les composants gras et aqueux se séparent naturellement) :
- Peg-7 Glyceryl cocoate,
- Laureth-X (X étant un nombre)
- différents additifs, variant selon l'effet recherché :
- des agents anticalcaires
- Tetrasodium EDTA (augmente également l'efficacité des conservateurs)
- des correcteurs/stabilisateurs de pH pour acidifier le shampooing (les acides ont à la fois un pouvoir anti-calcaire et de resserrer les écailles du cheveu)
- des colorants, identifié par CI suivi d'un chiffre
- des agents de texture
- Chlorure de sodium qui est utilisé pour épaissir le mélange (viscosité)
- acrylates (gélifiant)
- Silicone (effet démêlant, soyeux et doux, mais imperméabilisation du cheveu qui se dessèche dessous), ils sont repérables aux suffixes suivants : « -icone », « -iconol », « -siloxane », « -silane »
- des huiles essentielles simples ou composées (parfums, ou fragrance). S'ils contiennent des allergènes ces derniers doivent être mentionnés :
- Limonène (agrumes), Linalol (muguet/lavande), Hexyl cinnamal (camomille), Benzyl salicylate (musk), citronellol, Aldéhyde cinnamique (cannelle), Butylphenyl methylpropional (agent masquant)
- des agents nourrissants (huiles) pour nourrir le cheveu et le protéger (avec un risque d'alourdissement si la formule est trop dosée)
- se terminent souvent par « Oil » (corps gras) ou « Extract » (souvent des huiles essentielles)
- des agents dits « hydratants » tels que du miel ou la glycérine (qui limitent le dessèchement de l'épiderme) qui contribuent également à rendre la peau douce. Ils sont à éviter dans un milieu sec comme la montagne ou en plein été car ne pouvant plus capter l'eau de l'atmosphère (action humidifiante attendue), ils se mettent à capter l'eau de la fibre capillaire pour finalement la dessécher.
- des agents démêlants permettant aux shampooings « deux en un » de servir aussi d'après-shampooings
- cf. tensioactifs cationiques
- des agents médicamenteux (shampooings anti-poux, antipelliculaires, etc.)
- des agents anticalcaires
Inconvénients et polémiques à l'égard des shampooings détergents
Impact environnemental
Les shampooings, en raison de leur concentration en tensioactifs, colorants, parfums et substances biocides sont à éviter dans le milieu naturel.
Impacts sanitaires
Outre l'inconfort en cas de contact avec les yeux10, des personnes développent des allergies aux shampooings ou à certains de leurs composants, en particulier semble-t-il au laurylsulfate de sodium (sodium lauryl sulfate, SDS) dont on sait au moins depuis les années 1990 qu'il est un irritant pouvant causer des dermatites et un prurit11 (plus ou moins selon l'âge et la personne)11,12,13. Et on a récemment (2021) démontré que sous la douche des quantités significatives de microparticules/aérosols de shampooings sont inhalées et peuvent atteindre les poumons, alors que sous cette forme, la toxicité de ces molécules n'a pas été testée14
Selon l'Occupational Safety and Health Administration (OSHA), le NTP (National Toxicology Program, United States Department of Health and Human Services) et le CIRC (Centre International de Recherche sur le Cancer) ainsi que la CTFA (Cosmetic, Toiletry and Fragrance Association), ou encore l'American Cancer Society, le SLES (Sodium lauryl ether sulfate, dénomination INCI : sodium laureth sulfate) n'est pas cancérigène en dépit d'une rumeur qui a circulé à la fin des années 199015.
Le SLES est réputé légèrement moins irritant que le SDS, mais pourrait être dangereux car non métabolisable par le foie[réf. nécessaire].
Au-delà d'une certaine dose, le SDS est facteur d'ulcères aphteux ; référencé dans certains pays comme « rongeur de plaie »16,17, mais certains fabricants pourraient le préférer aux SLES (qui sont moins irritants) en raison d'un moindre coût.
Certaines souches de poux ont développé des résistances aux shampooings antipoux18 et ces derniers pourraient peut-être accroître le risque de leucémie aiguë de l'enfant19.
Polémiques
Les shampooings contiennent des ingrédients qui, s'ils ne sont pas adaptés au cheveu, au cuir chevelu et au mode de vie (fréquence de lavages) de leurs utilisateurs, peuvent avoir des effets indésirables. Ces effets indésirables sont souvent :
- des effets exagérés par une formulation mal adaptée (un shampooing pour cheveux gras va agresser un cheveu sec ou cassant) ;
- un shampooing pour cheveu sec appliqué sur un cheveu sain et normal sera moins efficace ;
- appliquer deux fois le shampooing (faire deux lavages) peut être trop agressif ;
- le silicone sur des cheveux secs peut conduire à des effets indésirables ;
- un cuir chevelu sensible peut s'irriter facilement à cause des agents chimiques (notamment les détergents).
Souvent les utilisateurs critiquent ces produits alors que leur usage nominal ne pose pas de problème, apparemment... selon les dires des fabricants (propos polémiques). Les critiques sont aussi formulées par les producteurs « biologiques » pour jouer sur la peur collective (préexistante parmi les consommateurs) quant à l'utilisation des produits chimiques (et donc accroître leur marché). Il faut faire attention car certains produits « biologiques » peuvent être également très agressifs (notamment en cas d'allergie).
Parabènes et isothiazolinones
Les conservateurs sont obligatoires (législation) notamment pour empêcher les shampooings de moisir. Cependant les conservateurs sont agressifs. Il existe actuellement trois familles de conservateurs :
- parabènes (parahydroxybenzoates) : irritants, les parabens ont remplacé les formaldéhydes en tant que conservateurs – les formaldéhydes sont nocifs et ne sont plus tolérés que dans le vernis à ongles. Tous les parabènes ne sont pas autant irritants les uns que les autres. Cependant, ils sont suspectés d'avoir une influence sur le système endocrinien, pouvant expliquer l'augmentation des nombres de cancers du sein ;
- isothiazolinones (méthyl- et méthylchloro- notamment) : ils ont remplacé les parabènes. A priori, sans effet néfaste au niveau oncologique (cancers), ils sont très irritants et peuvent causer des allergies ;
- conservateurs doux (notamment le benzoate de sodium) : à la suite des polémiques sur les parabènes et les isothiazolinones, de nouveaux conservateurs plus doux font leur apparition. Leur utilisation, encore marginale en 2015, devient néanmoins de plus en plus commune.
Sulfates
Les sulfates font polémique parce qu'ils sont détergents…, mais c'est aussi la raison qui fait qu'on les emploie. Certains sont plus agressifs. Mais si les lavages ne sont pas trop rapprochés et que le sujet n'est pas trop sensible, ils ne posent pas de problème. Sinon, des formules lavantes moins efficaces, mais sans sulfates arrivent de plus en plus sur le marché pour satisfaire à la demande grandissante.
Mouvement No-poo
Le mouvement no poo (de l'anglais : no shampoo) consiste à arrêter l'utilisation du shampooing dit « chimique » pour le remplacer par des produits naturels, ayant moins de conséquences sur la santé et l'environnement.
Notes et références
- Orthographe recommandée de 1990.
- (en) Fred Gray, Designing the Seaside, Reaktion Books, , p. 178
- (en) « How Often Should I Wash My Hair? » [archive], sur numehair.com (consulté le ).
- (en) « When It Comes To Shampoo, Less Is More » [archive] [« pour ce qui est du shampooing, moins c'est plus »], sur National Public Radio, (consulté le ) : « If you wash your hair every day, you're removing the sebum […] Then the oil glands compensate by producing more oil. »
- « No poo kézako ? » [archive], sur weebly.com (consulté le ).
- George C. Gleckler et James C. Goebel, Dry shampoo using chitin powder, (lire en ligne [archive])
- (en) Patrick Patrick et John Thompson, An Uncommon History of Common Things [« une histoire inhabituelle des choses habituelles »], National Geographic Books, , 304 p. (ISBN 978-1-4262-1227-7, lire en ligne [archive]), p. 194
- Agnès Walch, « Le shampoing », Historia, , p. 54 (ISSN 0750-0475)
- Liste des composés [archive], sur beaute-test.com
- (en) Jean-Yanique Petit, Vanessa Doré, Geneviève Marignac et Sébastien Perrot, « Assessment of ocular discomfort caused by 5 shampoos using the Slug Mucosal Irritation test », Toxicology in Vitro, vol. 40, , p. 243–247 (ISSN 0887-2333, DOI 10.1016/j.tiv.2017.01.002, lire en ligne [archive], consulté le )
- S. Marrakchi et H.I. Maibach, Sodium Lauryl Sulfate-Induced Irritation in the Human Face: Regional and Age-Related Differences, Department of Dermatology, School of Medicine, University of California, San Francisco, Calif., in Skin pharmacology and physiology, Journal of Pharmacological and Biological Research, vol. 19, no 3, 2006
- CIR publication, Final Report on the Safety Assessment of Sodium Lauryl Sulfate and Ammonium Lauryl Sulfate, Journal of the American College of Toxicology, 1983, vol. 2, no 7, p. 127-181.
- H. Loffler, I. Effendy, Skin susceptibility of atopic individuals, Department of Dermatology, Université de Marbourg, Allemagne. Contact Dermatitis, mai 1999 ; 40(5):239-42.
- (en) Yong-Hyun Kim et Kyuhong Lee, « Characterization of aerosols produced during shampoo use and harmful chemicals in shampoo aerosols », Environmental Research, vol. 204, , p. 111957 (DOI 10.1016/j.envres.2021.111957, lire en ligne [archive], consulté le )
- Rumor: Sodium Lauryl Sulfate Causes Cancer, The Cosmetic, Toiletry, and Fragrance Association, 13 octobre 2000
- L. Chahine, N. Sempson, C. Wagoner, The effect of sodium lauryl sulfate on recurrent aphthous ulcers: a clinical study, Compend. Contin. Educ. Dent., décembre 1997 ; 18(12):1238-40.
- B.B. Herlofson, P. Barkvoll, The effect of two toothpaste detergents on the frequency of recurrent aphthous ulcers, Acta Odontol. Scand., juin 1996 ; 54(3):150-3.
- KS. Yoon, JR. Gao, SH. Lee, JM. Clark, L. Brown, D. Taplin, Permethrin-resistant human head lice, Pediculus capitis, and their treatment, Arch. Dermatol. 2003 ; 139:994-1000
Voir aussi
Articles connexes
Liens externes
-
Notices dans des dictionnaires ou encyclopédies généralistes
- La tendance du low poo [archive], des shampooings solides plus naturels
- Le shampoing solide [archive], nouvelle façon de consommer durablement
- Portail de la chimie
- Nettoyage et hygiène
-
Savon
Un savon (ou savonnette).Le savon est un produit sous forme liquide ou solide composé de molécules amphiphiles obtenues par réaction chimique entre un corps gras et une base forte, spécifiquement l'hydroxyde de sodium pour le savon ou l'hydroxyde de potassium pour le savon noir, c'est le sel d'un corps grasnote 1 et du potassium ou du sodium2. Cette réaction est effectuée à chaud ou à froid.
Son caractère amphiphile lui donne des propriétés caractéristiques, notamment la capacité de ses composants moléculaires à se placer à l'interface entre la phase aqueuse (solvant hydrophile) et la phase lipidique (graisse hydrophobe), la formation de mousse et la stabilisation d'émulsions utiles pour le lavage3, molécules aussi utilisées comme épaississant entrant dans la composition de certains lubrifiants et de précurseurs de catalyseur.
Selon les périodes et les lieux, il a été considéré comme un produit cosmétique, « un produit d’hygiène et/ou comme un excipient ou encore comme une substance active, permettant la réalisation de médicaments ou de cosmétiques destinés à traiter aussi bien la gale que les brûlures, de réaliser des purges ou de mettre au point des préparations pour adoucir ou blanchir les mains ou pour allonger les cils »4.
Propriétés physiques et chimiques
Les savons commerciaux sont des mélanges de sels de sodium ou de potassium et d'acides gras. La longueur de la chaîne carbonée et surtout la présence d'insaturations, c'est-à-dire de doubles liaisons affectent les propriétés macroscopiques du savon, induisant par exemple une rigidité ou une mobilité spécifiques.
Les savons sont obtenus grâce à la réaction de saponification à partir du mélange de corps gras et d'une base forte. Le corps gras consiste en un triester de glycérol et d'acides gras, appelé couramment « triglycérides d'acides gras ». Les molécules des savons communs comportent une chaîne de huit à dix-neuf atomes de carbone, selon les corps gras utilisés, associée à une tête polaire.
Les savons se présentent sous des formes variées, selon leur teneur en eau, le type et le pourcentage de corps gras utilisés ou même selon la présence d'autres impuretés. Pour les savons durs et lorsqu'ils sont secs, ils forment des solides cassants. Humides ou gorgés d'eau, ces solides encore fermes glissent sur les surfaces, deviennent mous, voire perdent toute tenue dimensionnelle en déliquescence finale. Ces observations communes attestent leur nature de colloïdes, ainsi que leurs autres formes de mousses, de gels, etc.
Une molécule amphiphile
Les savons, précisément les sels d'acides gras5, ne sont en réalité pas solubles dans l'eau et dans l'huile, mais amphiphiles, c'est-à-dire qu'ils se placent à l'interface des phases eau et huile non miscibles. En absence d'une des phases, ils forment des structures moléculaires singulières, appelées micelles dans l'eau et micelles inverses dans l'huile. Si la proportion des phases change jusqu'à une teneur volumique équivalente, s'organisent des structures de phases cristal liquide6, appelées « états mésomorphes », caractérisées par une morphologie topologique en gouttelettes, puis en cylindres et enfin en planches parallèles. Au-delà de l'inversion de phase, on retrouve des organisations similaires.
Dans un récipient ou bassin rempli d'eau savonneuse, les molécules de savon s'arrangent en couches monomoléculaires couvrant en premier lieu des surfaces considérables à l'interface eau/air, comme le prouvent les travaux des devanciers d'Irving Langmuir. L'air est analogue à une matière lipophile et permet la création de bulles et figures légères respectant le principe de moindre énergie de structures, à partir de très fins films liquides d'eau savonneuse.
Piégées dans l'eau, elles forment des micelles qui peuvent solubiliser les graisses, c'est-à-dire stabiliser les gouttelettes d'huiles, enrober les matières grasses en formant des émulsions ou et des suspensions stables.
Le principe d'action des carboxylates (R-CO2−) d'alcalins (Na+, K+) à longue chaîne carbonée est dû à leur amphiphilie ; en effet, ils présentent :
- une chaîne apolaire donc hydrophobe et lipophile. C'est la queue de l'acide gras d'origine qui se mêle facilement aux graisses ;
- et à leur extrémité (la « tête »), un groupe carboxylate polaire donc lipophobe et hydrophile, qui minimise son énergie en étant en contact avec la solution aqueuse.
Par la présence d'un nuage de solvatation ionique en double couche, au-dessus de la surface hydrophile, la micelle est stabilisée.
Des propriétés propices au lavage et à l'hygiène corporelle
Les propriétés détergentes de l'eau savonneuse, agitée ou brassée, s'expliquent : les savons par leurs queues lipophiles se fixent à la salissure graisseuse ou à la tache d'huile, et l'extraient du tissu ou support en l'enveloppant dans des colloïdes ou gouttelettes sphériques qui se séparent et coalescent avec des myriades de micelles. Au cours de l'agitation, les gouttelettes ou les micelles peuvent éclater à l'instar de bulles de savon dans l'air, mais la séparation est éphémère. Elles reforment aussitôt des gouttelettes ou micelles dans ces phases liquides et condensées. On remarque que la présence de savon abaisse notablement la tension superficielle de l'eau et facilite le déplacement des molécules et corps dans la phase eau, donc le recouvrement par le savon des micelles éclatées. Le savon tensioactif accroît le pouvoir mouillant.
Mises en suspension et stabilisées dans l'eau malgré les chocs incessants, les gouttelettes huileuses et les poussières graisseuses qui ne peuvent plus s'agglutiner finissent par être entraînées par l'eau de rinçage. Le savon montre une autre facette de son pouvoir émulsifiant.
Ces extraordinaires propriétés de surface, la mouillabilité macroscopique du fait de l'abaissement de tension d'interface et surtout la stabilisation microscopique des poussières ou salissures grasses, facilement enlevées au cours du rinçage avec la phase aqueuse englobante et prépondérante, expliquent l'emploi de savons depuis l'Antiquité pour le lavage ou le nettoyage des surfaces.
Lors de la toilette, le savon dissout la graisse constituant le film hydrolipidique qui recouvre la peau. La graisse est entraînée dans l'eau avec les saletés qu'elle contient. L'inconvénient est que le film hydrolipidique sert à protéger la peau et à retenir son eau. Le savonnage — ou tout lavage à l'aide de produits comportant des tensioactifs, par exemple les gels pour la douche ou les lessives — fragilise donc la peau, jusqu'à ce que le film hydrolipidique se reconstitue, au bout de plusieurs heures.
Le savon est basique. Comme son pH est proche de 10 en solution très chaude et concentrée, lors de la toilette, il perturbe l'acidité de la peau, dont le pH est proche de 5. Le pH « naturel » de la surface de la peau de l'homme est en moyenne de 4,7. D'après une étude de Sara Lee Corporation, le simple usage d'eau du robinet augmenterait le pH de la peau humaine jusqu’à six heures après l'application de l'eau7. En Europe, le pH de l'eau du robinet est autour de 8,0. Une peau au pH en dessous de 5,0 serait en meilleure condition qu'une peau au pH au-dessus de 5,07. L'utilisation de produits cosmétiques, spécialement les savons, aurait une influence profonde sur ce pH, le rendant plus basique7.
Fusion, mélange et dispersion dans les solvants usuels
Le point de fusion des savons, même lorsque le sel d'acide gras est unique et purifié, reste assez mal défini, variant entre 200 °C et 250 °C, par mesure sur un banc Kofler. Le liquide obtenu est transparent, non laiteux.
À basses températures dans l'eau liquide, la dispersion du savon est difficile par agitation, sauf pour le laurate de sodium avec sa « petite » chaîne en C11. Plus la température est élevée, plus la dispersion est facile, donnant des eaux savonneuses claires et opalescentes. En milieu basique, pour un optimum de pH entre 10 et 12, est constatée une hydrolyse partielle en acides gras et en ions basiques libres. La dispersion est très faible dans le benzène, le toluène et la plupart des solvants organiques. La formation de micelles inverses est énergétiquement moins favorisée.
Savons industriels et dureté de l'eau
Les autres sels de carboxylates d'acide gras, en particulier alcalino-terreux, calcium, strontium et baryum, les sels d'aluminium ou de métaux lourds, sont très difficilement solubles dans l'eau. Au contraire, ils sont plus solubles dans les graisses et les huiles minérales, à l'instar des sels d'acide carboxylique à très longues chaînes ou contenant des cycles, comme celui du naphtalène. Ils sont utilisés dans l'industrie des colorants, et stabilisent les structures moléculaires des laques.
Une graisse contenant du savon destinée à la mécanique automobile.L'industrie des lubrifiants utilise, pour la fabrication des graisses, des carboxylates de lithium (Li+), de calcium (Ca2+), de magnésium (Mg2+) ou encore d'aluminium (Al3+). Les savons d'aluminium imperméabilisent les étoffes industrielles. Les médecins utilisaient les savons de plomb comme emplâtre simple.
Dans une eau dure, les molécules du savon réagissent avec les ions calcium et forment des dépôts de sels de calcium. Comme le savon est piégé, il faut une plus grande quantité de savon pour nettoyer à efficacité égale. Pour éviter ces inconvénients, on ajoute aujourd'hui aux savons des agents anticalcaires comme le très commun complexant EDTA.
Une eau dure, c'est-à-dire riche en cations calcium ou magnésium, a pour effet de faire disparaître le savon, c'est-à-dire de substituer les carboxylates de sodium ou potassium en carboxylates de calcium ou magnésium insolubles dans l'eau, formant la « crasse de savon ». Les détergents synthétiques sont conçus pour être moins sensibles à la dureté de l'eau.
Autres savons biologiques
Les organismes vivants, comme les plantes à racines, utilisent des analogues de savons pour contrôler ou entraver la migration des ions métalliques, comme la saponine. S'ils sont indésirables, les ions ne sont pas seulement précipités ou complexés, c'est la source métallique proche qui est souvent revêtue d'une couche protectrice[pas clair]. Ainsi, les objets en cuivre sont préservés dans la terre humide entre les racines d'un arbre.
Étymologie
Savon est issu du latin saponem (lire sāpōnem), accusatif singulier de sapo, saponis, terme d'abord attesté chez Pline au sens de « mélange de suif et de cendre utilisé par les Gaulois pour rougir les cheveux ». Le latin sapo est un emprunt au germanique *saipôn- « savon »; cf. le vieux haut allemand seifa, seipfa « savon » > allemand Seife « savon » et l'anglo-saxon sāpe, d'où l'angl. soap « savon »8,9,10.
Remarque : le Dictionnaire de la langue française d'Émile Littré, qui est un dictionnaire ancien (XIXe siècle) et qui n'est pas un dictionnaire étymologique, sous-entend à partir du propos de Pline, une origine gauloise11 au terme *sapon-, hypothèse rejetée de manière unanime par les travaux en linguistique contemporains.
Histoire
De l'Antiquité au IXe siècle
Premières traces au Moyen-Orient
La plus ancienne évocation de la réaction de saponification remonte au début du IIIe millénaire av. J.-C. dans les royaumes de Babylone et de Sumer12. À partir de 1877, Ernest de Sarzec, vice-consul de France à Bassorah en Irak, dirige des fouilles archéologiques sur le site de Telloh. Elles conduiront notamment à la mise au jour de cylindres d'argile, les cylindres de Gudea. Certains sont emplis d'une substance savonneuse. Le flanc de l'un d'eux, le « cylindre B », porte des inscriptions cunéiformes. Traduites par l'assyriologue François Thureau-Dangin en 1905, elles révèlent les détails d'un rituel annuel d'une durée de sept jours, mais surtout que les Sumériens maîtrisaient la saponification et composaient une préparation à base de graisse et des cendres bouillies, dont l'effet est proche du savon que nous connaissons :
« Ainsi, il me purifie avec l'eau, ainsi, il nettoie avec la potasse, ainsi se fait le mélange de l'huile pure et de la potasse… »
Une inscription retrouvée dans une excavation de Babylone décrit une recette où étaient bouillies des graisses animales mélangées à de la cendre13. Plus tard, le professeur Martin Levey du Temple (1913-1970) de l'université de Philadelphie, met au jour au même endroit d'autres tablettes d'argile datées de 2 500 ans av. J.-C. Elles indiquent que les Sumériens utilisaient la saponification pour débarrasser la laine du suint. La recette donne le détail des proportions en graisses et cendres. Une autre tablette datée de 2 200 ans av. J.-C. décrit quant à elle des savons dans lesquels sont inclus divers éléments médicinaux pour un usage thérapeutique14.
Une page du papyrus Ebers.Les Égyptiens, en guise d'hygiène corporelle quotidienne, se frottaient avec du natron, du carbonate de soude naturel extrait des lacs salés après évaporation, hydraté15. Le papyrus Ebers (Égypte, 1550 av. J.-C.) indique dans sa partie finale16 que les Égyptiens utilisaient une substance semblable à du savon à des fins pharmaceutiques. Cette substance était obtenue par un mélange de graisses animales (oie) ou végétale avec du sulfate de plomb (extraits de galène) ou de carbonate de sodium (extrait des bords du Nil). La pâte nommée « Trona »14, probablement toxique lorsqu'elle emploie du sulfate de plomb, était mise à reposer une journée avant son application sur les yeux. Des documents égyptiens mentionnent également qu'une substance similaire a été utilisée dans la préparation de la laine pour le tissage.[réf. nécessaire]
Un millénaire avant notre ère, les Phéniciens exportent le savon.[réf. nécessaire].
Le Talmud mentionne le tsapon utilisé pour nettoyer la laine17. Cependant le mot semble être un emprunt à une langue romane, tout comme l'hébreu סבון (sabón) est un emprunt au français.
Traces plus tardives en Europe
Les Germains et les Celtes utilisaient de la graisse de chèvre et des cendres de bouleau pour fabriquer leur savon18.
Le savon est, selon Pline19, une invention gauloise20, il décrit savons durs et savons mous. Le mot latin sapo a donné le français savon et les mots de même sens dans les autres langues romanes. Il s’agit d’un emprunt au proto-germanique *saip(ij)ǭ qui a donné l'allemand Seife et les mots de même sens dans les autres langues germaniques. Le proto-slave mydlo a donné le russe мыло et les mots de même sens dans les autres langues slaves.
Substance lavante et nettoyante connue en Europe occidentale depuis l'époque gauloise, il est fabriqué en quantité à partir de cendres alcalines ou potassiques (cendres de hêtre, de l'herbe à savon), de suif, de saindoux de sanglier (typique du « savon gallique ») ou d'huiles excédentaires non comestibles21. Il sert surtout, appliqué comme onguent sur les chevelures d'après la littérature latine, de shampooing ou de gel colorant à l'usage les longs cheveux en « rouge » (en fait chevelure blonde tirant vers le roux)22. À côté de la toilette des mains et du visage, il faut retenir l'emploi de substances de toilette complexes à base de suc de plantes, de savons mêlés de substances adoucissantes ou grasses, telles le beurre ou la glycérine, mélange de moins en moins agressif ou de plus en plus protecteur appliqué de la pointe à la racine des cheveux.[réf. nécessaire]
L'odeur d'eau savonnée et d'acide butyrique, lorsque le beurre a ranci, était barbare aux nez romanisés du Haut-Empire et même du Bas-Empire.[réf. nécessaire] Grecs et Romains se débarrassent des poussières du stade ou des taches en raclant un strigile sur leur corps huilé, avant la régénération par les massages et l'eau des thermes, aux bains successifs chaud, tiède et froid.
Gallipoli, ville portuaire sur la mer Ionienne dans le sud de l'Italie, a probablement été l'origine du savon de Marseillenote 2. Grâce à ses nombreuses oliveraies et à ses multiples pressoirs souterrains (frantoi ipogei), le Salento commercialise dans toute l'Europe une huile d'excellente qualité, destinée principalement à l'éclairage des villes et des fabriques textiles, mais aussi à un usage alimentaire. L'idée d'ajouter de la soude aux restes des olives qui venaient d'être pressées une première fois permit aux habitants de Gallipoli de fabriquer des savons blancs et de diversifier durablement leurs activités.[réf. nécessaire]
Le premier artisan « savonnier » de Marseille, cité (à la fin du XIVe siècle, vers 1370) par les archives, avait comme surnom Sabonerius, c'était un Juif nommé Crescas Davin23.
Le mot « savon » paraît avoir pour étymologie le mot latin sébum, suif, en grec, sapon. Les Celtes le désignaient sous le mot saboun, qui est resté dans la langue provençale24.
Du IXe siècle à 1920 : l'industrialisation de la production du savon
Moule à savon de Marseille.Au IXe siècle de notre ère, Marseille saponifie déjà son huile d'olive et produit de façon saisonnière son savon. Au XVe siècle, la région phocéenne semble un centre de production limité à la ressource locale. La soude marine qui désigne un carbonate de sodium impur provient des cendres obtenues par la combustion de plantes comme la salicorne (les cendres contiennent divers carbonates de sodium, calcium et potassium dans diverses proportions selon l'espèce).
La première grande fabrique française de savons fut fondée à Toulon vers 1430 ; un certain Palmier, industriel de Grasse, étant appelé par les syndics de l'époque à installer sa manufacture au nord de la place du Portalet (aujourd'hui la place Gambetta). La communauté toulonnaise s'engagea même pour mieux l'appâter à lui verser huit florins par an et à lui payer son loyer25.
De huit savonneries en 1600, le nombre passa à vingt en 1650. Le commerce du savon à Toulon fut si prospère que les archives ont enregistré jusqu'à plus de soixante mille quintaux de savons produits et exportés par an. Mais Colbert proclama la franchise du port de Marseille en 1669, taxant par ailleurs toutes les marchandises qui entraient ou sortaient du port de Toulon, donnant l'avantage économique aux Marseillais et signant la perte du monopole de la fabrication du savon par Toulon et la disparition une à une de ses savonneries25.
Broyeuse-mélangeuse pour la fabrication des savons de toilette.Après 1750, la fabrication de savon à Marseille devient industrielle, tant par les volumes que par les procédés normalisés. En 1791, le procédé proposé à l'Académie des Sciences par Nicolas Leblanc permet d'obtenir de la soude à partir du sel d'eau de mer, de chaux et de charbon. En 1823, le chimiste français Eugène Chevreul explique la réaction de saponification. Ses expériences menées dès la Restauration lui ont permis de démontrer la structure générique des corps gras, combinaison chimique entre le glycérol, déjà reconnu par Carl Wilhelm Scheele, et trois acides gras. Il est le premier à découvrir et affirmer que les savons sont des sels métalliques d'acides gras, et non pas des acides gras comme le croient alors les chimistes. Au XIXe siècle, des huiles de coprah et de palme importées à moindre coût d'outre-mer servent à la fabrication des savons. Le procédé d'Ernest Solvay réalise la synthèse industrielle du carbonate de sodium dès 1865, qui évince rapidement l'ancien procédé Leblanc, trop onéreux.
Le savon devient un produit de consommation courante, apparaît dans les maisons bourgeoises et complète la panoplie des femmes de ménage, s'activant en semaine dans les nombreux et récents lavoirs communaux. Sans rival avant 1907, il sert au blanchissage du linge, au dégraissage de draps et des laines. Jules Ronchetti invente en 1906 la poudre de savon à laver, commercialisée sous le nom de marque Persil. La société allemande Henkel lance un produit similaire l'année suivante.
Le savon durant la Seconde Guerre mondiale (1939-1945)
Le mythe du savon humain
Pendant et après la Seconde Guerre mondiale, une rumeur prétendait que les Nazis fabriquaient industriellement du savon à partir de graisse humaine provenant des camps de concentration. Le tribunal de Nuremberg a permis d'éclaircir cette légende qui reste tenace : il y eut seulement des tentatives pour fabriquer du savon de graisse humaine de manière industrielle (notamment à l'institut anatomique de Danzig en 1944 où l'on a utilisé des corps humains venant du camp du Stutthof) et des cendres de victimes furent l'objet de diverses expérimentations, mais rien n'a corroboré la thèse d'une production massive de savon par un tel procédé26.
Le savon dans les camps de concentration
Le United States Holocaust Memorial Museum conserve un ensemble de savons mis à disposition des prisonniers des camps de concentration dont les photos sont disponibles sur son site internet27. Il conserve aussi des savons utilisés par les Nazis durant cette même période dont les photos sont également disponibles sur le site du musée28.
De 1920 à nos jours
Début XXe siècle, l'hydrogénation des corps gras accroît le nombre et la variété des savons. Entre 1920 et 1930, alors que Marseille reste le principal centre de fabrication du savon en France, la concurrence survient avec les détergents synthétiques ou agents tensioactifs. Ces agents lavants sont utilisés encore aujourd'hui dans les shampooings, les gels douches et les « savons sans savon ».
Légendes
La légende du Mont Sapo
Le mont Sapo est une montagne fictive qui aurait existé selon la légende quelque part près de Rome.
Selon la légende, les anciens Romains célébraient des holocaustes animaux sur ses pentes. Les cendres de bois des feux de leurs autels se mêlaient à la graisse des animaux sacrifiés, formant une sorte de savon primitif. Ce liquide savonneux aurait coulé vers les bords argileux d'un cours d'eau voisin, où les habitants auraient constaté qu'à cet endroit, le linge se pouvait être nettoyé particulièrement facilement et efficacement. C'est pourquoi le savon tirerait son nom latin, sapo, du nom de la montagne.
Cependant, aucun texte n'indique l’existence d'un tel relief et les noms géographiques actuels des environs n'indiquent aucun lien. Cette histoire apparaît dans un certain nombre de sources récentes, notamment en ligne, notamment le site Web de l'Association Soap and Detergent ou l'American Cleaning Institute29, ou encore dans le livre Perfumes, Cosmetics and Soaps de W. A. Poucher, paru en 197513. Ce récit procéderait donc de la réécriture fantaisiste en anglais de l'histoire du savon en lui inventant une origine quasi mythologique.
Fabrication
Chaudières à savon.Le choix du type de savon à fabriquer dépend des besoins, de la disponibilité des ingrédients, mais aussi des utilisateurs du savon30. Les corps gras ou triesters du glycérol employés se caractérisent en général par des chaînes aliphatiques de huit à dix-neuf atomes de carbone, après hydrogénation.
Principales matières grasses utilisées
Le tableau suivant liste les matières grasses qui sont le plus souvent utilisées lors de la fabrication des savons :
Molécules de savon selon l'acide gras
Acide gras Nom IUPAC Dénomination Savon C12:0 Acide dodécanoïque Acide laurique Laurate de sodium / potassium C14:0 Acide tétradécanoïque Acide myristique Myristate de sodium / potassium C16:0 Acide hexadécanoïque Acide palmitique Palmitate de sodium / potassium C18:0 Acide octadécanoïque Acide stéarique Stéarate de sodium / potassium C18:1ω9 Acide cis-9-octadécénoïque Acide oléique Oléate de sodium / potassium - par type d'huile ou graisse :
Matière grasse
(huile ou graisse)Nom INCI
de la matière grasseNom INCI
(valable pour l'Amérique du Nord)
du savon obtenu*Acide gras dominant Suif (graisse de bœuf) Adeps Bovis Sodium Tallowate Acide cis-9-octadécénoïque Saindoux (graisse de porc) Adeps Suillus Sodium Lardate Acide cis-9-octadécénoïque Huile d'arachide Arachis hypogaea Sodium Peanutate Acide cis-9-octadécénoïque Huile d'olive Olea europaea Sodium Olivate Acide cis-9-octadécénoïque Huile de coprah (noix de coco) Cocos nucifera Sodium Cocoate Acide dodécanoïque Huile de palme Elaeis guineensis Sodium Palmate Acide hexadécanoïque Huile de palmiste Elaeis guineensis Sodium Palm Kernelate Huile de baies de laurier Laurus nobilis Sodium laurate *Si le savon est un savon liquide fabriqué à base de potasse, il faut remplacer « sodium » par « potassium » dans les noms INCI.
Pour la fabrication artisanale de savon, il existe des « calculateurs » en ligne permettant de doser les différents ingrédients du savon31.
Saponification des corps gras
Le savon traditionnel ou industriel en cuve des maîtres savonniers est le produit d’une réaction chimique nommée saponification des corps gras. Cette transformation lente est une des plus anciennes réactions chimiques connues et maîtrisées par l'humanité. Il s'agit d'une simple hydrolyse en milieu basique au cours de laquelle un mélange de corps gras — graisses animales ou huiles végétales — est hydrolysé par une base forte, soit la potasse ou hydroxyde de potassium KOH, soit la soude ou hydroxyde de sodium NaOH, à une température comprise entre 80 °C et 100 °C.
L’hydrolyse des corps gras produit du glycérol et surtout un mélange de carboxylates de sodium ou de potassium qui constituent les molécules du savon. Les savons fabriqués à partir de soude sont durs. Les savons fabriqués à partir de potasse sont mous ou liquides.
Fabrications industrielles
Fabrications et procédés industriels ont varié depuis les premières mises au point vers 1750. La fabrication en cuve est autrefois caractérisée par l'empâtage, le relargage, l'épinage, le lavage et séchage. Voici les étapes-types de la Belle Époque :
- l'empâtage consiste à mélanger les corps gras à la lessive de soude. Ici une solution de soude, faiblement basique, est chauffée à ébullition. Le corps gras végétal, c'est-à-dire l'huile d'olive, d'arachide, de coton, de palme, de noix de coco, de sésame ou le corps gras animal, suif ou huile de poisson, est ajouté par petites doses et souvent sous forme de mélange complexe selon le savon à obtenir. À noter qu'il reste dans la lessive de soude une quantité définie de vieilles solutions savonneuses, ou solutions mères soutirées d'une précédente saponification. Pour obtenir du savon mou on utilisera des huiles de colza, d'œillette ou de chènevis et de la potasse caustique (KOH) ;
- le relargage utilise des lessives concentrées puis des lessives salées qui permettent une meilleure séparation des sels basiques d'acide gras, c'est-à-dire du savon formé qui est relargué et surnage en grumeaux ;
- l'épinage, qui prend son nom de l'épine, robinet du bas de la cuve, consiste à soutirer l'eau salée et le glycérol, appelé glycérine ;
- le lavage consiste à répéter l'ajout de solutions salines, pour emporter glycérol et lessives résiduelles. Le séchage permet d'obtenir des pains de savons secs et consistants.
Les deux étapes médianes ont parfois disparu au cours des années 1920 pour favoriser une épuration rapide et permettre une coulée à l'état liquide dans des bassins peu profonds, appelés mises où le savon se solidifie avant d'être débité en bandes, puis après séchage, marqué et débité en cubes.
Le nettoyage des matières grasses est souvent suivi au milieu du XXe siècle d'hygrogénation des acides gras polyinsaturés, afin d'augmenter la compacité du savon produit. La saponification est conduite à haute pression et à 130 °C, par introduction d'une lessive de soude à 7 % dans le corps gras fondu en présence de solution-mère de savon. Le savon formé est séparé avec une solution saline, qui entraîne le glycérol et sur laquelle il surnage.
Depuis les années 1970, l'hydrolyse des graisses par de l'eau sous pression et à haute température, en présence de savon de zinc faisant office de catalyseur, donne en continu acide gras et glycérol, immédiatement séparés par distillation. L'acide gras est neutralisé par la soude et donne le savon.
L'acide gras, produit intermédiaire, est la base d'une chimie, bien plus diversifiée que dans les anciennes savonneries. Il peut être converti en sels d'ammonium quaternaire, savons cationiques utilisés comme liquides antiseptiques. Ainsi, le chlorure de N,N,N-triméthyloctadécylammonium.
Composition des savons commerciaux
Depuis 1950[réf. nécessaire], les savons tendent à être distingués des autres molécules détergentes. Toutefois, le langage familier des laboratoires et usines assimile par commodité savon (soap), détergent (detergent) ou tensioactif (surfactant). Ces derniers produits souvent pétrochimiques diffèrent plus par leurs compositions, conformations caractéristiques et propriétés d'usage que par les mécanismes évoqués ci-dessous.
Les matières premières pour fabriquer du savon sont les matières grasses et la soude, éventuellement la potasse. Un savon bien fini ne contient ni soude ni huile. Les savons sont principalement composés de différents carboxylates de sodium, molécules de savon. Ils contiennent aussi de l'eau et des additifs variés.
La glycérine ou glycérol est un sous-produit de la saponification que l'on peut éliminer. Mais elle est laissée ou rajoutée parfois au savon car elle apporte des propriétés hydratantes.
Additifs
À la recette de base, on peut ajouter différents additifs selon l'effet recherché :
- des agents anticalcaires, pour réduire la sensibilité des savons à précipiter en eau dure, c'est-à-dire chargée en sels d'alcalino-terreux ;
- des conservateurs ;
- des colorants ;
- des parfums ;
- des agents surgraissants (huiles) pour fabriquer un savon surgras ;
- des agents hydratants comme le miel ;
- des abrasifs pour fabriquer un savon exfoliant ;
- des huiles essentielles extraites de plantes ;
- des substances aux propriétés antiseptiques, notamment antibactériennes, ou antifongiques.
Sous sa forme la plus simple, le savon est un produit détergent totalement biodégradable. Les additifs peuvent être polluants pour l'environnement.
Remarques toxicologiques
Les multiples débouchés commerciaux des savons, que représentent l'usage souvent quotidien ou hebdomadaire du shampooing, de la mousse à raser, de la toilette corporelle à la lessive, de la vaisselle à l'entretien des sols et des sanitaires… jusqu'à la lutte contre les pucerons, sont la cible de produits « modernes » spécialisés. Peut-être par leurs grandes variétés et en conséquence de notre méconnaissance toxicologique et écologique, ces produits sont discutables. L'impact écologique à long terme est accru par les productions gigantesques, les emballages et la pollution des eaux usées. Leur innocuité n'est pas nulle : risques de sensibilisation à de multiples allergies ou allergies dues à la multitude de composants nouveauxnote 3. Leur efficacité peut être mise en doute. Ainsi, pour la toilette corporelle, les produits « sans savon » se sont installés sur la croyance en l'effet déshydratant du savon alors que des savons, par exemple à la glycérine, respectent particulièrement bien l'épiderme.
Il est remarquable que dans ces produits standardisés et inévitables par le commerce de masse, le savon soit remplacé par le laureth sulfate de sodium nommé sodium laureth sulfate dans les compositions.
Types de savons anciens et modernes
Un savon d'Alep.Le savon commercial se présente sous forme de bloc (pain, cube, formes ovalisées, etc.), de poudre, de paillettes fines (lessives), de mousses, de gels (gel douche) ou de solutions, comme le savon liquide.
L'art savonnier distingue, plus ou moins indifféremment :
- suivant la provenance géographique d'origine ou la couleur :
- le savon Azul e Branco est fabriqué au Portugal ; il est bleu et blanc-jaunâtre,
- le savon de Castille est un savon biodégradable préparé uniquement avec de l'huile d'olive, de l'eau et de la soude,
- le savon d'Alep, le plus ancien savon syrien, est à base d'huile d'olive et d'huile de baies de laurier,
- le savon de Marseille est préparé avec des huiles végétales et de la soude. Il comporte au moins l'équivalent de 72 % d'acides grasnote 4,
- le savon blanc. Le Grand Larousse du XIXe siècle l'assimile au banal savon de Marseille ou aux différents savons de toilette. La couleur blanche indique qu'il s'agit d'un savon sodique, de teinte claire ou nettement moins sombre que les différents « savons noirs » à la potasse ou lessive potassique. À noter que l'industrie suisse a promu une fabrication de savon de toilette à partir de l'huile de tournesol, nommée savon blanc,
- le savon marbré comporte des lignes de savons ferreux non déposées, c'est-à-dire des carboxylates de fer précipités dans la masse du savon formé. Les fines marbrures sont vertes,
- le savon à froid est produit selon la méthode dite de saponification à froid,
- le savon de Soissons est un savon biodégradable préparé à base d'huile de colza ;
- suivant l'usage :
- une savonnette ou savon de toilette est un petit pain dur de savon d'aspect agréable, parfumé, coloré et neutralisée. À l'instar des savons ou mousses à raser, les savons de toilettes sont préparés à partir de suif et de noix de coco et contiennent les plus hautes teneurs en sel d'acides gras, supérieures à 76 ou 78 %. Cette composition élaborée — lavage soigné éliminant toutes traces d'alcali, présence de colorant, parfum, bactéricide, fongicide ou autres additifs pour une action au contact de la peau — le destine en premier lieu à la toilette ou l'hygiène du corps,
- le savon de ménage, autrefois pour le nettoyage domestique,
- le savon ponce est un savon à décrasser dans lequel il entre une charge minérale, sous forme de pierre ponce pulvérisée,
- un savon surgras est enrichi en agents (sur)graissants, par exemple des huiles végétales ; la présence d'huiles limite le dessèchement dû au savon qui enlève le film gras (film hydrolipidique) recouvrant naturellement la peau,
- un savon médical est un savon de Marseille surgras, avec apports antiseptiques tels que le soufre (savon au soufre pour la toilette quotidienne de patients acnéiques ou à peau grasse, abandonné depuis qu'on a montré qu'il était comédogène32), le phénol, l'ichtyol, le formaldéhyde, le sublimé de naphtol ou de salol, des goudrons ou du bois de Panama,
- un savon médicinal est un mélange de lessives de savonniers, avec des huiles d'amandes douces. Il est employé comme excipient dans la fabrication de pilules, ou prescrit comme laxatif,
- le savon dentifrice est un savon additionné de glycérol (glycérine) et de substances aromatiques, pour les soins de la bouche ;
- suivant l'aspect ou la composition :
- le savon liquide à la potasse est préparé à partir d'huile de ricin et de noix de palmier. Il a la plus faible teneur équivalente en acides gras : 15 à 20 % en masse,
- le savon noir ou savon mou est un savon plus ou moins mou au toucher, de teinte plus ou moins foncée et peu attirante (brunâtre, verdâtre, grisâtre, noirâtre) sans coloration. Les différents mondes paysans l'appelaient aussi savon vert, savon mou bleu, savon mou noir, etc. L'empâtage est réalisé avec des lessives de potasse et des huiles de chenevis, navette, œillette, colza, plus rarement à l'huile de linnote 5. Le produit fini est facilement coloré à l'indigo ou à l'encre, composé de tanin et de sels ferreuxnote 6. Il affiche une teneur équivalente en acides gras de l'ordre de 38 % en masse. Il est recommandé pour le nettoyage des carrelages bien qu'il existe aussi du savon noir pour le corpsnote 7. Aujourd'hui, il est très largement utilisé dans le monde arabe, notamment lors du rituel du hammam. Élaboré à base de matières végétales, il aurait des propriétés purifiantes,
- le savon noir à l'huile de lin. La saponification est ici réalisée traditionnellement avec de l'huile de lin et des lessives de potasse, à l'origine. Sa couleur est naturellement ambré sombre. On n'y ajoute pas de colorant. De même que le précédent savon noir, il affiche une teneur équivalente en acides gras de l'ordre de 38 % en masse et il est également recommandé pour le nettoyage des carrelages,
- le savon animal est obtenu avec la lessive des savonniers et des graisses animales, souvent du suif de bœuf,
- le savon transparent est obtenu par dissolution d'un savon de suif dans de l'alcool à chaud, puis refroidissement lent et coulage. Il s'appelle savon de glycérine lorsque l'alcool est le glycérol, nom actuel de la glycérine,
- le savon à raser ou mousse à raser, obtenu par saponification à la potasse, afin d'obtenir un produit fini plus mou. La basicité du savon à raser contribue à ramollir le poil. Il était à la fin du XIXe siècle souvent un simple savon de toilette,
- le savon d'atelier, savon spécial prévu pour nettoyer les hydrocarbures et suies (pour les garagistes, mécaniciens, imprimeurs, mineurs, etc.), mais qui peut être source d'allergies graves33.
Le savon dans l'art
Bulles de savon, Jean Siméon Chardin.L'oreille qui tombe, Frédérique Nalbandian.- Dans son œuvre Bulles de savon (1734), Jean Siméon Chardin évoque le caractère éphémère de la vie au travers d'une bulle de savon soufflée par un jeune homme. La figure du jeune homme en premier plan donne à l’œuvre un thème des vanités : le garçon est paresseux et perd son temps à souffler des bulles éphémères, bien qu'elles semblent amusantes au premier abord.
- Dans son œuvre de la broche Nestlé, le travail de l'artiste musicien Joshua Kosker (en) ré-affirme le lien entre le savon et le corps en utilisant un système d'attache issu des bijoux traditionnels. Le savon devient alors le symbole de la fragilité d'un quotidien toujours plus précieux34.
- Dans son œuvre Soap Making exposée au Frost Museum de Miami, l'artiste Orestes de la Paz a utilisé sa propre graisse issue d'une liposuccion pour créer vingt savonnettes. Les détails de son œuvre sont disponibles sur le site de l'artiste35. Ce dernier indique sur son site s'intéresser au lien entre corps qui devient objet et la banalisation de l'art de la performance. Une vidéo a été réalisée pour illustrer la création de l’œuvre36.
- Dans le livre (1996) et le film Fight Club, Tyler Durden utilise de la graisse humaine pour fabriquer des savons de haute qualité.
- La sculpture de savon en art contemporain exprime soit une forme éphémère liée au corps et mise en abstraction (Cf. Frédérique Nalbandian), soit une fragrance qui revient à la sensation plus primaire de l'environnement qui entoure le corps qui se déplace (Cf. Labyrinthe de savon odorant versé à même le sol de Nicolas Momein37).
Autres savons dénommés par analogie
La pratique que des puristes peuvent stigmatiser en abus de langage dénomme pourtant d'autres savons depuis des temps fort anciens ou récents, recourant à l'analogie d'emploi, de fonction ou d'action sur la matière et les surfaces :
- un savon sans savon, comme son nom l'indique, ne contient pas de molécules de savon. Appelé aussi pain dermatologique ou syndet (pour synthetic detergent), il est à base de tensioactifs synthétiques. Son pH est proche du pH de la peau ;
- les savons antiseptiques, à base d'iode par exemple, ou antifongiques sont utilisés pour des soins particuliers de dermatologie. Ceux-ci ne contiennent pas de molécules de savon et sont pour la plupart des détergents cationiques ;
- le savon blanc de montagne ou oropion est une variété d'argile déposée dans les eaux thermales ;
- le savon des verriers désigne le dioxyde de manganèse MnO2 employé pour décolorer le verre dans les creusets de fusion.
Notes et références
Notes
- À propos des deux définitions du substantif masculin « savon » en français, voir la fiche du CNRTL1.
- Étymologiquement, il semble que ce soit la cité des gaulois, autre nom des Phocéens en Méditerranée orientale.
- En particulier sur les cuirs chevelus, les peaux desséchées, etc.
- Il s'agit de la noble définition artisanale, quoique pas toujours respectée ni vérifiée. D'un point de vue industriel ou mondial, il contient bien souvent de l'huile de coco et de l'huile de palme. Il comporte au moins l'équivalent de 61-63 % d'acides gras.
- Réservée à l'éclairage ou à de multiples usages ou emplois d'artisanat.
- La couleur bleue joue un rôle d'azurant, pour faire paraître la surface lavée plus blanche ou plus propre (aspect visuel).
- Pour certaines contrées encore isolées au XIXe siècle, le savon noir est le seul connu ou préparé localement.
Références
- Fiche [archive] du CNRTL.
- (en) « soap [archive] », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- Notions d'hydrophilie et d'hydrophobie [archive] [PDF], sur prepa-cpe.fr. Elles sont liées à la tension de surface, observable et mesurable aux limites des phases, évidemment à l'échelle macroscopique. Jean Poré, Émulsions, micro-émulsions, émulsions multiples, op. cit. Les molécules des savons sont souvent assimilées à des tensioactifs (surfactants) (terme franglais de recherche).
- Coiffard et Couteau 2020.
- « Les savons : pourquoi et comment? - Bio Linéaires / le magazine professionnel des points de ventes bio, biodynamiques et diététiques » [archive], sur Bio Linéaires / le magazine professionnel des points de ventes bio, biodynamiques et diététiques, (consulté le ).
- Jacques Amouroux, Éric Blin et Marina Coquery, La chimie et la nature, EDP Sciences, , 300 p. (ISBN 978-2-7598-1054-3, lire en ligne [archive]), p. 127.
- (en) H. Lambers, S. Piessens, A. Bloem, H. Pronk et P. Finkel, « Natural skin surface pH is on average below 5, which is beneficial for its resident flora », International Journal of Cosmetic Science, vol. 28, no 5, , p. 359–370 (lire en ligne [archive]).
- Savon [archive], sur le site du CNRTL.
- Dictionnaire historique de la langue française sous la direction d'Alain Rey, vol. 3, éditions Dictionnaire Le Robert, 2012, p. 3246a.
- Albert Dauzat, Jean Dubois et Henri Mitterand, Nouveau dictionnaire étymologique et historique, Éditions Larousse, 1974 (ISBN 2-03-029303-2), p. 673b.
- Dictionnaire Littré, « Article savon » [archive], sur littre.org, xixe siècle (consulté le ).
- A. Pons-Guiraud, L'Histoire du savon [archive]. In: Progrès en dermato-allergologie, Montpellier, 2011, Groupe d'études et de recherches en dermato-allergologie.
- (en) W.A. Poucher, Perfumes, Cosmetics and Soaps : Volume I The Raw Materials of Perfumery, Springer Netherlands, (ISBN 978-94-009-5693-3, 9400956932 et 9789400956919, OCLC 851370428, lire en ligne [archive]).
- J. Falbe, Surfactants in Consumer Products : Theory, Technology and Application, Springer, Berlin, Heidelberg, , 548 p. (ISBN 978-3-642-71545-7, 3642715451 et 9783642715471, OCLC 840294778, lire en ligne [archive]).
- Josset Patrick, Emplois thérapeutiques du natron dans l'Égypte antique et le monde gréco-romain [archive]. In: Revue d'histoire de la pharmacie, 84e année, no 311, 1996, p. 385-396.
- (en) « Papyrus Eber » [archive] [PDF], sur mjn.host.cs.st-andrews.ac.uk, (consulté le ).
- Talmud Babli Baba Kama 93b.
- Agnès Walch, « Le savon », Historia, , p. 52 (ISSN 0750-0475).
- Pline, Lib. XXVIII, chap. 51 Lire en ligne [archive].
- Cours d'histoire nationale, Volume 1, Alexandre Joseph Namèche, Édition Fonteyn, 1853, p. 27
- Monique Closson, Propre comme au Moyen Âge, Historama no 40, juin 1987.
- Dictionnaire des Antiquités grecques et romaines, t. 4, vol. 2, article sapo, p. 1062.
- Lambert G. (1886), Histoire de Toulon, Impr. du Var ; cité par Laurence Coiffard et Céline Couteau, « Un produit de santé peut-il changer de statut au gré des circonstances ? Éléments de réflexion avec l’exemple précis du savon », Médecine & Droit, vol. 2020, no 165, , p. 141–144 (PMCID PMC7985184, DOI 10.1016/j.meddro.2020.07.001, lire en ligne [archive], consulté le ).
- Léon Louis Paul Marie Lieutier, Du savon de Marseille et des substances qui servent à sa fabrication, Paris, (présentation en ligne [archive], lire en ligne [archive] [PDF]).
- « Toulon - La première fabrique de savons est née à Toulon » [archive], Var-Matin, 18 février 2010.
- Pratique de l'Histoire et Dévoiement négationniste (PHDN): Le savon humain : rumeur, réalité et histoire [archive].
- (en) « Grooming and hygiene equipment and supplies » [archive], sur collections.ushmm.org (consulté le ).
- (en) « Light brown bar of curd soap produced Nazi German » [archive], sur collections.ushmm.org (consulté le ).
- (en) « Soaps & Detergent: Prehistoric to Middle Ages » [archive], sur cleaninginstitute.org (consulté le ).
- Martial Gervais Oden Bella 2014, p. 12.
- Calculateur de composants d'un savon : Soapcalc.net [archive].
- Otto H. Mills, Michael Porte et Albert M. Kligman, « Enhancement of comedogenic substances by ultraviolet radiation », British Journal of Dermatology, vol. 98, no 2, , p. 145–150 (ISSN 0007-0963 et 1365-2133, DOI 10.1111/j.1365-2133.1978.tb01615.x).
- C. De Laulanié, M.N. Crépy et D. Choudat, Attention au savon d'atelier, Archives des maladies professionnelles et de l'environnement, vol. 68, no 3, juillet 2007, p. 253-257 (résumé et illustrations [archive]).
- (en) « Nestle » [archive], sur artsandculture.google.com, (consulté le ).
- (en) « Soap Making » [archive], sur orestesdelapaz.com, (consulté le ).
- (en) « Soap Making » [archive] [vidéo], sur vimeo.com, (consulté le ).
- « Bouilleur de savon de Nicolas Momein, Usine Fagor » [archive], (consulté le ).
Annexes
Bibliographie
- D'Arcet, Pelletier et Lelièvre, Rapport sur la fabrication des savons, sur leurs différentes espèces, suivant la nature des huiles et des alcalis qu'on emploie pour la fabriquer, et sur les moyens d'en préparer partout, avec les diverses matières huileuses et alcalines que la Nature présente, suivant les localités, in Journal de Physique et de Chymie, et d'Histoire-naturelle et des Arts, (Introduction au § D), septembre 1794, p. 161-178, lire en ligne [archive] (suite à partir du § E), décembre 1794, p. 405-428, lire en ligne [archive].
- Roger Leblanc, Le savon : de la préhistoire au XXIe siècle, Éd. Pierann, Montreuil-l'Argille, 2001, 396 p. (ISBN 2-912297-52-4)
- (en) Brian Lewis, So clean: Lord Leverhulme, soap and civilization, Manchester University Press, Manchester, 2008, 246 p. (ISBN 978-0-7190-7804-0)
- Édouart Moride, Traité pratique de la savonnerie, matières premières, matériel, procédés de préparation des savons de toute nature, Librairie Polytechnique, Baudry et Compagnie éditeurs, Paris, 1895, 2e éd., 448 p., avec catalogue de livres sur les industries chimiques. Édition numérisée [archive], sur Gallica.
- Martial Gervais Oden Bella, Technique améliorée de fabrication artisanale de savons et de détergents, Wageningen, Pays-Bas, ISF Cameroun et CTA, coll. « Pro-Agro », , 44 p. (ISBN 978-92-9081-551-8, lire en ligne [archive] [PDF]).
- Jean Poré, Émulsions, micro-émulsions, émulsions multiples, Éditions techniques des industries des corps gras, Neuilly, 1992, 270 p. (ISBN 978-2-9507241-0-6).
- (en) Luis Spitz (dir.), Soap manufacturing technology, AOCS Press, Urbana (Ill.), 2009, 474 p. (ISBN 978-1-893997-61-5)
- Laurence Coiffard et Céline Couteau, « Un produit de santé peut-il changer de statut au gré des circonstances ? Éléments de réflexion avec l’exemple précis du savon », Médecine & Droit, vol. 2020, no 165, , p. 141–144 (ISSN 1246-7391, DOI 10.1016/j.meddro.2020.07.001, lire en ligne [archive], consulté le )
Articles connexes
Liens externes
- « Savon : entrez dans le bain » [archive], Eurêka ! , France Culture, 10 août 2022.
-
Liquide vaisselle
Du liquide vaisselle.Le liquide vaisselle (ou liquide à vaisselle au Québec) est un détergent liquide utilisé pour laver la vaisselle. Il est doté de propriétés tensioactives afin d'enlever les graisses alimentaires et les salissures.
Description
Les produits vaisselle sont surtout efficaces sur les taches de graisses et de protéines. Ils le sont peu sur les taches dues aux sucres.[réf. nécessaire]
Il peut aussi se rencontrer sous forme de poudre à vaisselle, spécialement pour les lave-vaisselle, en effet, le liquide utilisé pour laver la vaisselle à la main ne doit pas être utilisé en machine, car il produirait une mousse considérable. Le lave-vaisselle requiert un produit spécifique à base de tensio-actifs non moussants.
Historique
Composition
Utilisation
Notes et références
Article connexe
- Portail de la chimie
- Nettoyage et hygiène
-
Détergent
Un détergent (ou agent de surface, détersif, surfactant) est un composé chimique, généralement dérivé du pétrole, doté de propriétés tensioactives, ce qui le rend capable d'enlever les salissures. La détersion est un élément d'hygiène fondamental, puisqu'il permet d'éliminer une grande partie des bactéries présentes en particulier sur la peau, et sur les ustensiles servant à la préparation et à la consommation des repas.
Action chimique
La molécule du détergent est amphiphile, c'est-à-dire dotée d'une tête polaire, hydrophile (ou lipophobe), attirant l'eau, et d'une longue chaîne hydrocarbonée, apolaire, hydrophobe (ou lipophile), attirant les lipides (huiles et graisses). L'extrémité hydrophile est miscible à l'eau tandis que l'extrémité lipophile de la molécule est miscible au solvant apolaire. Les molécules du détergent peuvent donc s'insérer à l'interface eau-lipide et détacher les graisses d'une surface. Les groupements polaires peuvent être chargés positivement, négativement ou neutres. La présence conjointe de groupes fonctionnels possédant une affinité, et pour l'eau, et pour les graisses, permet la formation de micelles.
Typologie
On distingue les détergents :
- anioniques (alkylbenzènesulfonates, alkylsulfates, alkylarylesulfates), principalement utilisés dans les lessives et produits de nettoyage ;
- cationiques (chlorhydrates d'amine, ammoniums quaternaires), principalement utilisés dans les milieux industriels et hospitaliers, en raison de leur propriété désinfectante ;
- ampholytes, s'ionisant négativement (anions) ou positivement (cations), selon les conditions du milieu ;
- non ioniques (hydroxyles) — utilisés dans l'industrie textile, la métallurgie et en cosmétologie (hygiène corporelle et beauté) en raison d'une moindre agressivité et d'un faible pouvoir moussant1.
Exemples
Les lécithines, qui sont des phosphoaminolipides se trouvant dans tous les tissus végétaux ou animaux (notamment dans le jaune d'œuf), sont des tensioactifs naturels.
Voici quelques exemples de molécules de synthèse :
- dodécylbenzènesulfonate de sodium : C18H29SO3Na ;
- SDS (dodécylsulfate de sodium) : NaSO4(CH2)11CH3 ;
- CTAB (bromure d'hexadécyltriméthylammonium ou bromure de cétrimonium) : (CH3)3N(CH2)15CH3Br ;
- CTAC (chlorure d'hexadécyltriméthylammonium ou chlorure de cétrimonium) : (CH3)3N(CH2)15CH3Cl ;
- Triton X-100 : C8H15C6H4(OC2H4)9OH ;
- Brij 35.
Consommation
Le règlement de l'Union européenne CE 648/2004 appliqué depuis , impose sur l'étiquetage des détergents ménagers la mention de tout conservateur ainsi que celle de vingt-six substances allergisantes des compositions parfumantes lorsque leur proportion pondérale dépasse 0,01 %. Ce règlement a pour objectif de permettre aux consommateurs de choisir plus facilement le bon produit, de l'utiliser en toute sécurité et d'en obtenir les meilleurs résultats possibles. En outre, sur demande, le personnel médical peut obtenir des fabricants une liste exhaustive des composants d'un détergent afin de pouvoir déterminer l'existence éventuelle d'un lien de causalité entre l'apparition d'une réaction allergique et l'exposition à une substance chimique donnée. D'autre part, l'industrie a élaboré de nouvelles icônes cognitives afin de rendre l'étiquetage plus efficace, plus clair et plus facile à comprendre pour les consommateurs. Les industriels négocient avec le gouvernement français un engagement de réduction des quantités de lessive par dose : la dose de poudre est passée de 150 g en 1998 à 100 g en 2005, et ne devrait être plus que de 60 à 70 g en 2010. Compte tenu du nombre de lavages — environ cinq milliards par an[réf. nécessaire] — , cela représente 500 000 tonnes de produit.
Références
- Colonna P., Kammoun A., Montagne X. et Sales C. (éd.), Quels VEGétaux et systèmes de production durAbles pour satisfaire les besoins en bioénergie, synthons et matériaux biosourcés ? [archive] [PDF], Rapport CIRAD - IFPEN - INRA, France, 2013, 409 p.
-
Déboucheur
Déboucheur à pompe à air professionnel.Furet (plomberie) avec enrouleurDispositif à eau haute pression tournanteAction dans le tuyau du dispositif à eau haute pression tournantUn déboucheur est un dispositif mécanique ou une matière conçus pour déboucher les lavabos, éviers et canalisations. La matière peut être chimique : acide, basique (« alcaline »), ou biologique, et conditionnée sous forme liquide ou solide.
Dispositifs mécaniques
Il existe des dispositifs mécaniques, respectueux de l'environnement :
- démonter/nettoyer/remonter le siphon et le curer ;
- utiliser une ventouse ;
- un dispositif à air haute pression, sur le même principe que la ventouse.
- un furet (outil muni d'un foret), une sonde tire-bourre
- un dispositif à eau haute pression tournante.
Déboucheurs chimiques
Les produits chimiques déboucheurs sont dangereux, pouvant provoquer de graves brûlures, et toxiques pour les organismes aquatiques.
Déboucheurs basiques
Les déboucheurs basiques contiennent principalement de l'hydroxyde de sodium (soude caustique), certains contiennent de l'hydroxyde de potassium. Ils sont disponibles sous forme de liquide ou solide.
Les liquides peuvent contenir de l'hypochlorite de sodium (composant de l'eau de Javel) et de la soude (hydroxyde de sodium ou de potassium) en concentration pouvant atteindre 50 %. D'autres produits corrosifs sont des bicomposants, les deux parties sont mélangées lors du versement dans l'ouverture de la canalisation. Le mélange réagit, ce qui forme un gaz capturé par des tensioactifs, formant une mousse dense. Le but de ce moussage est d'adhérer à la paroi intérieure de la canalisation, afin de déloger une plus grande proportion de substances ayant provoqué son obstruction.
Les solides se présentent sous la forme de granulés d'hydroxyde de sodium ou de potassium, ce qui permet une concentration effective plus élevée. Certaines formules solides, brevetées, contiennent de plus des particules d'aluminium qui réagissent avec l'hydroxyde solide dans l'eau pour échauffer la solution caustique jusqu'à ébullition.
Les déboucheurs caustiques peuvent dissoudre les cheveux (qui contiennent des protéines) et les matières grasses dans les tuyaux, via une hydrolyse alcaline (en) d'amides et d'esters, respectivement :
- RCONH2 (amides ou protéines) + HO− → NH3 + RCOO−
- RCO2R’ (esters ou corps gras) + HO− → R'OH + RCOO−.
Déboucheurs acides
Les déboucheurs acides contiennent le plus souvent de l'acide sulfurique. Celui-ci peut dissoudre les protéines et les corps gras par hydrolyse, et le papier toilette par réaction de déshydratation.
-
Déboucheur contenant du H2SO4 concentré1.
Déboucheurs biologiques
Non corrosifs, les déboucheurs à base d'enzymes s'utilisent dans toutes les canalisations. En général, ils ne sont efficaces que si le bouchon laisse l'eau s'écouler. Leur temps d'action est plus long (au moins huit heures en traitement curatif ou en entretien préventif), comparé à la plupart des autres déboucheurs.
Autres
- Verser : de l'eau bouillante ou du vinaigre sur un mélange de sel de cuisine et de bicarbonate de soude.
- Du vinaigre seul2.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Drain cleaner » (voir la liste des auteurs).
- L'acide sulfurique vire la bande de papier pH au rouge et la brûle immédiatement.
- https://fr.wikihow.com/déboucher-une-canalisation-avec-du-vinaigre [archive]
-
Poubelle
Poubelle à roulettes individuelle, classique au début du XXIe siècle.Une poubelle est un récipient destiné à accueillir les déchets.
La poubelle doit son nom au préfet de la Seine, Eugène Poubelle qui imposa l'usage de ce récipient à ordures d'immeuble en 1884.
Origine en France
Eugène Poubelle, inventeur de la poubelle à la fin du XIXe siècle.Le , sous la IIIe République, le préfet de la Seine, Eugène Poubelle, signe un arrêté préfectoral relatif à l'enlèvement des ordures ménagères, pour lutter contre l'entassement des déchets dans les rues de la région parisienne1. Cet arrêté oblige les propriétaires parisiens à fournir à chacun de leurs locataires un récipient destiné à leurs ordures ménagères, et dispose que : « Dorénavant, les ordures ménagères seront ramassées par l'intermédiaire d'un récipient de bois garni à l'intérieur de fer blanc, de manière que rien ne puisse s'en échapper. Ces récipients pourront également contenir des cendres chaudes sans risque d'incendie ».
L'arrêté précise la dimension des récipients (de 80 à 120 litres, moins de 10 kg à vide), la présence d'un couvercle, d'une anse, etc. Après trois mois de délibérations, de travail en commissions, et malgré l'opposition des chiffonniers et hygiénistes2, et à la suite du vote du conseil municipal de Paris le , le Bulletin municipal officiel de la ville de Paris3 daté du publie un nouvel arrêté intitulé « Enlèvement des ordures ménagères, Règlement », également signé par Eugène Poubelle, qui supprime la taille minimale des récipients et précise les modalités de leur utilisation. Le reste du département de la Seine suit progressivement.
Dès sa création, le tri des déchets est prévu dans trois « récipients » spécifiques4 :
- un « récipient commun » pour les « résidus de ménage » ;
- un « récipient spécial » pour les « débris de vaisselle, verre, poterie, etc. provenant des ménages » ;
- un « récipient spécial » pour les coquilles d'huîtres et moules.
Dès le , Le Figaro critique la « boîte Poubelle » (avec une majuscule)5. Très rapidement, ces récipients sont appelés « poubelles »6. Le mot entre dès 1890 dans le supplément du Grand Dictionnaire universel du XIXe siècle.
Usages courants
Poubelle publique à Paris. Le sac transparent facilite l'examen du contenu et empêche la dissimulation d'engin explosif, dans le cadre de la prévention du terrorisme.Depuis Eugène Poubelle, des éboueurs sont chargés d'enlever régulièrement les poubelles déposées sur les trottoirs ou dans les cours. Ils utilisent pour cela un véhicule spécialisé (camion-poubelle) dont le contenu est acheminé dans des décharges.
Bientôt, l'emploi de poubelles s'impose en France dans chaque commune et chaque foyer, puis dans tous les pays industrialisés qui adopteront le principe du ramassage des ordures par l'intermédiaire d'une poubelle.
Au XXIe siècle, la poubelle est un récipient aux multiples formes et couleurs, doté d'un couvercle fabriqué en divers matériaux et de diverses dimensions. Certaines poubelles automatiques possèdent soit un mode d'ouverture du clapet mécanique, actionnable avec le pied, soit un détecteur de présence permettant d'ouvrir automatiquement le clapet lors d'une présence à proximité. D'autres reconnaissent automatiquement la matière présentée et facilitent ainsi un recyclage efficace7.
Composition
Les poubelles sont généralement fabriquées à base de polyéthylène haute densité (PEHD) ou de polypropylène (PP) et mises en forme par moulage par injection.
-
Deux modèles de poubelles danoises Vipp.
-
Poubelle sur la voie publique composée d'un cadre cylindrique et couvercle accueillant un sac à usage unique en PVC.
-
Seau à ordure en métal galvanisé avec couvercle articulé et renforcements longitudinaux, de type bedoucette.
-
Benne à ordures à Londres.
-
L'urne à Saint-Pétersbourg.
-
Poubelles dans un local d'immeuble à Courbevoie.
-
Poubelles d'entreprises sur un campus tertiaire à Châtenay-Malabry.
-
Poubelle parlante au Parc Astérix.
-
Conteneurs collectifs enterrés à Písek (République tchèque).
Sac poubelle
Philippe Auguste, en 1183, lança une campagne de propreté dans les rues de la capitale du fait de conditions sanitaires exécrables. Il créa d'une part les caniveaux8 et d'une autre part indirectement il poussa les paysans à récolter les déchets dans des sacs de jute ou chanvre pour fertiliser leurs champs.
Le sac poubelle est un sac étanche conçu pour être placé à l'intérieur d'une poubelle. Il en existe plusieurs sortes. C'est dans les années 1950 que trois Canadiens, Larry Hansen, Harry Wasylyk et Frank Plomp inventent le sac poubelle9.
Sens figuré
« Poubelle » désigne un lieu ou objet en très mauvais état :
- Ce bois est une poubelle ! (il est rempli de détritus, comme une décharge)
- L'Erika était un navire-poubelle ! (il était délabré et en très mauvais état)
- Cette voiture est une véritable poubelle !
Notes et références
- Histoire des déchets de Lutèce à Paris, le préfet Eugène Poubelle, l'inventeur de la poubelle [archive], Planète Écho
- En raison du risque présenté par le stockage des déchets à l'intérieur des logements pendant la nuit. Voir Ségard, Jean-François La poubelle a 120 ans ! [archive] L'Hermine, n° 9, hiver 2004, p.1-5.
- Consultable à la bibliothèque de l'hôtel de ville de Paris. Les deux arrêtés sont reproduits in Ségard op.cit. [archive]
- Non en vue d'un recyclage, mais pour que les chiffonniers ne se blessent pas en fouillant les « récipients ». Ségard op.cit. [archive]
- Planète Écho, L'Hermine, n°15, hiver 2009. [lire en ligne [archive]].
- Jugie, Jeanne-Hélène Poubelle-Paris, 1883-1896 : la collecte des ordures ménagères à la fin du XIXe siècle Larousse-Sélection du Reader’s Digest, Collection Jeunes talents, 1993, 288 p. Barles, Sabine L’invention des déchets urbains : France 1790-1970 Seyssel, Champ Vallon, 2005, 297 p. Ségard op.cit. [archive]
- « La poubelle de tri intelligente : quel avenir ? » [archive], sur Maison zéro déchet, (consulté le )
- « L'histoire des déchets » [archive], sur Site de Tom (consulté le )
- (en) Chris Chang-Yen Phillips, « Canadians invented the garbage bag. Can we solve the mess they made? » [archive], sur cbc.ca,
Annexes
Articles connexes
Liens externes
-
Papier toilette
Pour l'épisode de la série télévisée, voir Papier toilette (South Park).
Le papier hygiénique1, papier toilette (Europe1) ou papier de toilette (Amérique du Nord1), est un papier qui sert à nettoyer l'anus ou le méat urétral, le plus souvent après avoir déféqué et/ou uriné.
Il est souvent conditionné en rouleaux, et dispensé grâce à un distributeur ou porte-rouleau installé dans les toilettes.
Il est également appelé vulgairement « papier cul », désignation abrégée en « PQ » en Europe.
Un rouleau de papier toilette.Historique
Dans le monde
Instruments de nettoyage anal connus comme le Chuugi (en) de la période Nara (710 à 784) au Japon. Les rouleaux modernes en arrière-plan sont présents pour la comparaison de taille.Illustration du brevet d'invention du rouleau de papier toilette perforé.Les premiers papiers toilettes ont été fabriqués en Chine au IIe siècle av. J.-C.2.
Durant l'époque de Nara, au VIIIe siècle, les usagers des toilettes japonaises se munissent de chūgi (en), bâtons en bois de 20 à 25 cm de longueur servant à nettoyer le canal anal aussi bien interne qu'externe. À la même époque, les autres civilisations n'utilisent pas de papier toilette, le Japon et la Chine gardant le secret de fabrication de ce matériau. Le nettoyage de la région anale après la selle s'effectue, selon les pays, les climats et les coutumes, avec de l'eau (au moyen, par exemple, d'un bidet), des pierres, divers végétaux (feuilles, herbes, épis de maïs), des fourrures d'animaux, des bâtons, de la neige, des coquillages, des tissus à base de laine, de dentelle ou du chanvre, voire à l'aide de la main3.
Dans la Grèce et la Rome antiques, on a recours dans les latrines à un accessoire constitué d'une éponge ou d'un linge fixé à un bâton et appelé en latin tersorium (dérivé du verbe tergere « nettoyer »). Selon certains, on l'emploie seulement pour l'entretien des toilettes4. Selon d'autres, on les utilise pour se nettoyer soi-même3 ; après usage, ces éponges sont rincées et replacées dans un seau rempli d'eau salée ou vinaigrée5. Une autre technique pour se nettoyer le postérieur consiste à employer des fragments de céramique ovales ou circulaires appelés pessoi (pluriel de pessos, « caillou »), comme l'attestent les « fouilles de nettoyage » archéologiques qui révèlent dans les latrines des tessons de poterie recouverts de résidus stercoraux6. Selon Aristophane : « Trois pierres peuvent suffire pour se torcher le cul si elles sont raboteuses. Polies, il en faut quatre. »7.
Certains chercheurs suggèrent que les pessoi peuvent être utilisés comme ostraca, les fèces imprégnant le nom de la personne ostracisée3 .
Les tessons retaillés à cet effet peuvent se déliter en de petits fragments susceptibles d'entraîner une irritation locale, des lésions de la peau ou des muqueuses, voire des hémorroïdes externes8.
En 1857, aux États-Unis, Joseph Gayetty est le premier à fabriquer industriellement et sous une marque du papier pour des besoins hygiéniques (nom : Gayetty's Medicated Paper)9. Son nom est marqué sur tous les papiers qu'il produit. À partir de 1935, l'entreprise Northern Tissue parvient à ne plus avoir d'échardes sur le produit fini10.
En juin 1891, Seth Wheeler dépose un brevet pour l'invention de papier toilette en rouleau. Trois mois plus tard, il améliore le système en imaginant des lignes de perforations pour détacher plus facilement les feuillets11.
L'utilisation d'eau pour se nettoyer est fréquente en Asie du Sud-Est, en Inde et dans les pays musulmans, où les gens utilisent la main gauche (impure) pour se nettoyer avec de l'eau et la main droite (pure) pour saluer et manger.
En France
Papier hygiénique des années 1960, en paquet de feuilles.Introduit en France au début du XXe siècle, le papier toilette est longtemps considéré comme un produit de luxe. Son utilisation ne se généralise que dans les années 1960.
Au XVIe siècle, Rabelais fait état des expériences de son héros Gargantua sur de nombreux procédés, y compris le papier mais
« Tousiours laisse aux couillons esmorche
Qui son hord cul de papier torche ».Il arrive à la conclusion « qu’il n’y a tel torchecul que d’un oyson bien dumeté, pourveu qu’on luy tieigne la teste entre les iambes. Et m’en croyez suz mon honeur. Car vous sentez au trou du cul une volupté mirificque, tant par la doulceur d’icelluy dumet, que par la chaleur temperée de l’oizon, laquelle facillement est communicquée au boyau cullier & aultres intestines, iusques à venir à la region du cueur & du cerveau. Et ne pensez poinct que la beatitude des heroes & semidieux qui sont par les champs Elysiens soit en leur Asphodèle ou Ambrosie ou Nectar, comme disent ces vieilles ycy. Elle est selon mon opinion en ce qu’ils se torchent le cul d’un oyzon »12.
Au XIXe siècle, dès l'industrialisation du papier, on a recours à l'utilisation du papier journal. Puis le papier hygiénique dit « bulle-corde lisse », appelé ainsi à cause de sa teinte corde, s'impose progressivement pour constituer l'essentiel du marché de 1950 à 1970. Aujourd'hui le « bulle-corde lisse » a pratiquement disparu. L'usage du papier « crêpé » se développe à la fin des années 1950. En 1966, Ferdinand Béghin rachète une cartonnerie et a l'idée d'un papier à base d'ouate de cellulose, plus agréable au toucher7. Ce nouveau type de papier toilette connaîtra une croissance particulièrement marquée au cours de la décennie 1970-1980. Aujourd'hui on trouve du papier-toilette décoré de motifs ou de textes, parfumé, en double, triple ou encore quadruple épaisseur. Le marché évolue vers des produits de plus en plus différenciés et les nouvelles technologies visent à accroître en permanence douceur et résistance du produit.
Le marché du papier toilette
Le marché du papier hygiénique et ménager en Europe représente 8,5 milliards d'euros et représente 26 % de la consommation mondiale. Chaque Européen en utilise en moyenne 13 kilogrammes par année[source insuffisante]13.
En 2012, il est estimé dans le monde à 45 milliards de dollars américains. La plus forte croissance ces dernières années s'enregistre en Chine et au Brésil[source insuffisante]14. De fortes disparités culturelles marquent son usage, comme en Allemagne, où Procter & Gamble a mis sur le marché en 2012 un nouveau produit ayant un format et des couleurs spécifiques15.
Un Français consomme 71 rouleaux de papier toilette par an, un Anglais 127, un Allemand 134[source insuffisante]7.
Évolution du marché en France
Si le produit est connu en France depuis le début du XXe siècle, le marché du papier toilette ne démarre vraiment en France qu'à la fin de la Seconde Guerre mondiale en détrônant l'utilisation du papier journal. Le papier toilette connaît ensuite une utilisation croissante pendant un demi-siècle.
Aujourd'hui, ce marché devenu mature, en raison de la présence du papier toilette dans la totalité des foyers, poursuit une croissance plus modeste mais régulière. En 2014, il représente 786 millions d'euros en France.
Dispositifs
Orientation du rouleau
Distribué horizontalement dans un support mural, le papier en rouleau peut être placé de deux différentes façons : l'orientation par-dessus (brin libre à l'opposé du mur) ou l'orientation par-dessous (brin libre contre le mur), selon les goûts. L'orientation « par-dessus » est celle généralement retenue par les fabricants et les spécialistes.
Jumbo
Dans les collectivités on utilise souvent les formats Mini Jumbo et Maxi Jumbo qui se présentent en gros rouleaux, ou bobines, nécessitant des distributeurs spéciaux de grande taille.
Différents types de papiers toilette
Le papier toilette existe en plusieurs épaisseurs. Certains fabricants, comme Renova, proposent des papiers de couleur à des prix élevés16.
Erreurs de graphie
Beaucoup de personnes n'écrivent pas « papier toilette »17, mais plutôt « papier toilettes »18, pensant que, plutôt que de servir à la toilette, il est dispensé aux toilettes. Cette graphie erronée ne repose sur la définition d'aucun dictionnaire19.
Impact sur l'environnement
Usage écologiqueLe WWF dénonce l'usage abusif de papier toilette issu directement de fibres vierges et préconise pour sa fabrication l'utilisation de papier recyclé. Chaque jour l'équivalent de 27 000 arbres serait utilisé pour fabriquer du papier hygiénique ou ménager20. Le WWF ne précise néanmoins pas dans quelles proportions ces fibres proviendraient de déchets de l'industrie du bois, difficilement exploitables pour un autre usage21.
De plus, le papier toilette jeté dans les canalisations augmente le taux de matières organiques à traiter dans les stations d'épuration22, et implique en cela l'utilisation de davantage de produits chimiques[Source?].
Ce problème est encore aggravé par les fabricants qui proposent un tube de papier toilette soluble dans l'eau, encourageant les utilisateurs à jeter le tube dans la cuvette23. Certaines marques proposent un rouleau sans tube central.
Considérant que 90 rouleaux de 200 feuilles de papier toilette pèsent 6kg24 et que 1kg de papier nécessite 500 litres d'eau25, un rouleau de papier toilette nécessite donc 33 litres d'eau (= 6 ∗ 500 / 90 ). Si on considère 10 feuilles par commission, soit 1/20e de rouleau on arrive à 1,65 litre par commission si on utilise du papier toilette. À noter que si le rinçage à l'eau qui consomme environ 0,6 litre d’eau/minute se termine par un séchage au papier toilette ou avec une lingette ou serviette réutilisable qu'il a fallu produire et qui faut ensuite laver, le gain n'est pas évident.
Les solutions de rechange
On estime que 70 % de la population mondiale se rince à l'eau et n'utilise pas de papier toilette26.
Le jet d'eau pressurisé est également employé dans la plupart des pays musulmans, mais aussi en Asie du Sud-Est comme en Indonésie, en Malaisie, aux Philippines et en Thaïlande, où il est généralement considéré comme étant plus hygiénique que le papier toilette. Ce jet d'eau est la version moderne d'une manière plus traditionnelle consistant à se laver le fondement en tenant d'une main une cruche ou une bouteille d'eau et en utilisant l'autre main pour le nettoyage, plus précisément l'extrémité des doigts.
Au Japon, les toilettes (privées et publiques) disposent de jet d'eau et de séchoir dirigés depuis un « tableau de bord », mais aussi de diffuseurs de musique pour couvrir les bruits, avec très souvent d'autres options technologiques qui paraissent souvent impressionnantes pour les étrangers, voire déroutantes27.
En France, l'invention du bidet a permis parfois un changement des pratiques.
De nouvelles alternatives écologiques voient peu à peu le jour comme l'utilisation de lingettes (industrielles ou fait-maison) lavables afin de supprimer l'usage du papier toilette. Une fois utilisées, ces lingettes sont lavées en machine à 60 degrés. Utilisées avec des toilettes sèches, la consommation d'eau est alors quasi nulle.
Notes et références
- « papier hygiénique » [archive], Le Grand Dictionnaire terminologique, Office québécois de la langue française (consulté le )
- J. Needham, Science and civilization in China, Volume 5, Part 1 : paper and printing, 1986, p. 122, 123
- (en) P. Charlier, L. Brun, C. Pretre et I. Huynh-Charlier, « Toilet hygiene in the classical era », British Medical Journal, vol. 345, no 7888, , p. 41 (DOI 10.1136/bmj.e8287)
- Extrait de l'article Latrina [archive] du Dictionnaire des Antiquités grecques et romaines : « Nous sommes bien peu renseignés sur le mobilier des latrines antiques. Par Sénèque [cf. Lettres à Lucilius, 70, 20 ; voir aussi Martial, 12, 48, 7], on sait qu'on y trouvait une éponge fixée à un bâton. Certains auteurs, Montaigne [Essais, 1, 49] entre autres, ont cru que cet instrument servait au même usage que nos papiers modernes ; mais c'est une erreur : ces éponges faisaient ce que font aujourd'hui nos petits balais. »
- Steve Mirsky, « Toilet Issue : Anthropologists Uncover All the Ways We’ve Wiped » [archive], sur Scientific American,
- (en) JK. Papadopoulos, « A contextual approach to pessoi (gaming pieces, counters or convenient wipes ?) », Hesperia, vol. 71, , p. 423-7
- « PQ: les Français au bout du rouleau », Les Echos, (lire en ligne [archive], consulté le ).
- (en) DM. Janicke, MR Pundt, « Anorectal disorders », Emergency Medicine Clinics of North America, vol. 14, no 4, , p. 757-88
- (en) « First proprietary lavatory paper » : Paraphernalia: The Curious Lives of Magical Things [archive], par le professeur Steven Connor, 9 juin 2011, page 130 (pages 120 et suivantes), aux Éditions Profile Books, (ISBN 978-1-84765-282-9).
- « Pierre, feuille, papier… toilette ! » [archive], sur Libre Service Actualités (consulté le ).
- Brian Edwards, « Original toilet roll patent ends that "over or under" argument FOREVER » [archive], sur mirror (consulté le )
- Gargantua, chap. XIII
- « lci.tf1.fr/science/2005-11/toi… »(Archive.org • Wikiwix • Archive.is • http://lci.tf1.fr/science/2005-11/toilettes-engloutissent-270-000-arbres-par-jour-4896133.html" rel="nofollow" class="external text">Google • Que faire ?).
- (en) « Global toilet paper market » [archive],
- (en) « How Charmin toilet paper cleaned up the German market » [archive]
- « Vos fesses pourraient-elles se passer de papier toilette? » [archive], sur Slate.fr, (consulté le ).
- Comptage par Google de : papier toilette [archive]
- Comptage par Google de: papier toilettes [archive]
- Le Larousse indique « papier toilette » [archive].
- (en) Toilet paper wipes out 27,000 trees a day [archive]
- (en) Don’t flush our forests and wildlife down the toilet [archive]
- Pourquoi le papier WC est-il rose ? [archive], l'éco-blog.
- Paris déclare la guerre au rouleau de papier toilette biodégradable [archive], Le Figaro, 19 juillet 2014.
- « Coronavirus : de combien de rouleau de papier toilette a-t-on besoin pendant le confinement ? » [archive], sur France Bleu, (consulté le )
- « Usages : consommations industrielles » [archive], sur sagascience.cnrs.fr (consulté le )
- « Du papier toilette plus doux pour la planète », Libération, (lire en ligne [archive], consulté le )
- (en)James Brooke, « Japanese Masters Get Closer to the Toilet Nirvana » [archive], The New York Times, (consulté le )
Voir aussi
Articles connexes
Liens externes
-
Notice dans un dictionnaire ou une encyclopédie généraliste
- Le papier toilette, histoire d’un tube [archive], Johanna Seban, Télérama, 11 novembre 2020
-
Serviette hygiénique
À gauche, un modèle de serviette hygiénique sans ailettes, suivi par trois modèles de serviettes hygiéniques avec ailettes.Une serviette hygiénique est une protection hygiénique externe principalement destinée à absorber les flux sanguins issus des menstruations, mais aussi consécutifs à une intervention chirurgicale du vagin ou du col de l'utérus ou encore après un accouchement. Contrairement au tampon hygiénique, il s'agit d'une protection externe qui se fixe sur les sous-vêtements de type culotte.
Certaines serviettes hygiéniques, mais aussi les couches pour bébé, sont conçues avec des super-absorbants, produits chimiques permettant une meilleure absorption mais qui peuvent causer des effets indésirables.
Histoire
Illustration de catalogue de réclame pour un dispositif de protection hygiénique (1905).En 1800, des « sacs à chiffons » précurseurs des serviettes hygiéniques font leur apparition[réf. nécessaire].
En 1896, la première serviette hygiénique est commercialisée aux États-Unis, par Johnson & Johnson, toutefois sans se populariser1.
Les serviettes sont produites industriellement après la Première Guerre mondiale2. En effet, les infirmières utilisaient les bandages pour absorber le flux menstruel. La société Kimberly-Clark s'en inspire pour commercialiser son premier modèle de serviette hygiénique nommé Kotex en 1921, en même temps que Johnson & Johnson lance le modèle Modess. Elles sont alors amovibles, et se fixent grâce à des épingles ou des ceintures qui se fixent à la taille. L'apparition d'une bande adhésive permettant de se passer d'épingles survient une cinquantaine d'années plus tard1.
Pendant la Seconde Guerre mondiale, les femmes fabriquaient elles-mêmes leurs serviettes hygiéniques avec un morceau de vieille serviette éponge plié en trois. Un ruban cousu sur la ligne médiane permettait de fixer la serviette avec des épingles de sûreté à une ceinture portée à même la peau. Ces serviettes étaient surnommées « drapeaux », car elles étaient étendues sur les fils à linge pour sécher, comme des oriflammes3.
Un brevet portant sur une hygiénique a été posé en 1957 par Mary Kenner 4.
Description
Une serviette hygiénique moderne jetable avec des ailettes.La serviette hygiénique consiste en une bande d'une largeur proche de celle de la vulve, bande plus ou moins longue et épaisse selon les besoins en absorption. Elle s'attache au sous-vêtement avec une bande adhésive par exemple pour les serviettes jetables5, ou par des bouton-pressions qui permet à la serviette d'entourer la culotte6. La serviette hygiénique jetable se fixe généralement grâce à une bande adhésive sur le sous-vêtement et peut également comporter des ailettes adhésives sur ses côtés5.
En général la serviette se divise en trois parties : le dessus qui est fait pour rentrer en contact avec la vulve et absorbe le sang, retenu dans la couche intermédiaire de la serviette, le dessous qui doit empêcher le sang de couler et qui est au contact du sous-vêtement.
Composition des serviettes
Les serviettes jetables sont principalement composées de matières synthétiques (plastiques et polymères de synthèse) et de fibres de bois ou de coton. Les voiles sont composés de plastique, tandis que les polymères de synthèses sont employés pour former le gel absorbant des serviettes. Certaines serviettes hygiéniques peuvent comporter des parfums ou des colorants, d'autres peuvent être blanchies au chlore7.
Serviette hygiénique lavable
Commercialisées ou confectionnées à la main, les serviettes hygiéniques lavables sont généralement composées d'une bande de coton dessus, d'un insert en tissu absorbant ou en fibre de bois à l'intérieur et d'un tissu anti-fuite dessous. Deux systèmes existent : les « tout en un » ou les « systèmes avec inserts »[réf. nécessaire].
Utilisation
Une serviette hygiénique usagée.La serviette se fixe sur le sous-vêtement selon des systèmes différents (bande adhésive, boutons-pressions, épingles à nourrice...) en période de règles, de fuites urinaires, lors d'un retour de couches ou une opération qui cause des écoulements sanguins.
La serviette jetable recueille le sang qui s'écoule du vagin et nécessite d'être changée toutes les quatre à six heures5, et une serviette lavable se change une fois remplie juste avant d'être mise à tremper et nettoyée5.
Drogue
En Indonésie les serviettes périodiques sont utilisées comme « drogue des rues ». En faisant bouillir les serviettes, le gel est récupéré pour être bu afin d'obtenir un effet planant8.
Aspect sanitaire
Notes et références
- (en) Miranda A. Farage, Lisa Lennon et Funmi Ajayi, « Products Used on Female Genital Mucosa », Current Problems in Dermatology, vol. 40, , p. 90-100 (DOI 10.1159/000321058).
- « http://www.levif.be/info/reportages-photo/dix-inventions-que-l-on-doit-a-la-premiere-guerre-mondiale/album-4000593834882.htm#photo-9 »(Archive.org • Wikiwix • Archive.is • http://www.levif.be/info/reportages-photo/dix-inventions-que-l-on-doit-a-la-premiere-guerre-mondiale/album-4000593834882.htm#photo-9" rel="nofollow" class="external text">Google • Que faire ?).
- Françoise Héritier, Au gré des jours, Paris, Odile Jacob, , 151 p. (ISBN 9782738139566 et 2738139566, OCLC 1015204857, lire en ligne [archive]), p. 90
- https://www.vice.com/en/article/mb5yap/mary-beatrice-davidson-kenner-sanitary-belt [archive]
- Jack Parker, Le grand mystère des règles, Flammarion, , 250 p. (ISBN 978-2-0814-0864-7), p. 59-63.
- Jack Parker, Le grand mystère des règles, Flammarion, , 250 p. (ISBN 978-2-0814-0864-7), p. 75-79.
- 60 millions de consommateurs, « Obtenir la composition d’un Tampax ? C’est pas coton ! » [archive], (consulté le ).
- Claire, « En Indonésie, des ados se défoncent avec des serviettes hygiéniques usagées » [archive], sur Le Tribunal Du Net, (consulté le ).
Voir aussi
Article connexe
Liens externes
-
Serviette de table
Caractéristiques Matériaux Forme Utilisation Usage Serviette de table pliée artistiquement.Une serviette de table est une pièce de tissu individuelle, généralement de forme carrée ou rectangulaire, avec laquelle on s'essuie la bouche ou les mains au cours des repas.
Origines
L'usage des serviettes apparaît très tôt dans l'histoire humaine.
Les Romains recouraient ainsi aux serviettes (mappa) mais l'usage voulait que ce soient les convives qui les apportent. Il s'agissait alors le plus souvent d'un simple tissu blanc, parfois brodé de fils d'or, que l’on utilisait pour s’essuyer le visage.
Au début du Moyen Âge, c'est à même la nappe que les commensaux s'essuyaient les doigts et la bouche. Deux options furent tour à tour utilisées : le « doublier » — une pièce de tissu pliée en deux et placée sur une planche à tréteaux — puis la « longuière », qui ne couvrait que les seuls bords de la table.
Vers le XIIIe siècle, des torchons dénommés « touailles » sont pendus au mur. On les utilise aussi bien pour s'essuyer collectivement que pour recouvrir les restes des agapes. Généralement longs de quatre mètres, ils sont pliés en deux sur un bâton.
La serviette de table dans son acception actuelle, personnelle, trouve son origine au XVe siècle, sous le règne de Charles VII. À cette époque, l’usage de la fourchette est marginal et les convives mangent directement avec les doigts. Les serviettes sont par conséquent régulièrement renouvelées durant les repas, dans le respect d’un strict cérémonial faisant successivement intervenir maître d’hôtel, gentilhomme, grand chambellan et officiers de la bouche.
La Renaissance marque un tournant important. Les serviettes en lin damassé, parfumées d’eau de rose ou d’autres essences, commencent à se généraliser : elles sont nouées autour du cou afin de protéger les larges collerettes tuyautées qui sont alors fréquemment portées. La collerette imposante nécessite l'aide d'une personne pour la nouer, acte à l'origine de l'expression « avoir du mal à joindre les deux bouts1 ». Les « arts de la table » naissent au même moment et le pliage des serviettes y occupe rapidement une place importante2.
Au XVIIIe siècle, la serviette de table devient un support d’ostentation : décorée, brodée, colorée, elle exprime le statut social de ses possesseurs et assigne un statut à chacun, donnant tout son sens à l’expression populaire « on ne mélange pas les torchons et les serviettes ».
Mattia Giegher, Le tre trattati : trattato delle piegature (traité du pliage) Padoue, éditeur Paolo Frambotto, 1639.L’expansion coloniale et le commerce de la Compagnie des Indes font par la suite surgir de nouveaux tissus qui donnent naissance à des usages jusqu’alors inédits, comme les serviettes à café ou à chocolat.
Au XIXe siècle, les serviettes de table intègrent le trousseau constitué à l’occasion d’un mariage. Aux côtés des draps, des nappes et des mouchoirs, elles constituent un véritable patrimoine auxquelles les jeunes filles accordent une importance considérable.
Aujourd’hui
Les serviettes de table en tissu laissent de plus en plus souvent place aux serviettes en papier (de couleur unie ou à motifs), lorsque ce n’est pas au simple « essuie-tout » . Les versions textiles sont moins fréquemment utilisées au quotidien mais davantage pour des repas de fête ou dominicaux.
Restauration
Le maître d'hôtel d'un restaurant, les serveurs et garçons de café portent traditionnellement une serviette appelée liteau sur le bras gauche. Elle est utilisée dans les restaurants à la place du papier gaufré ou de la dentelle pour présenter certains mets.
Savoir-vivre
Les règles de savoir-vivre veulent qu'on utilise sa serviette avant de porter son verre à la bouche, et chaque fois que les lèvres sont marquées par un mets.
On ne noue par ailleurs sa serviette autour du cou que pour manger des fruits de mer à décortiquer.
Notes et références
- « Joindre les deux bouts (expression) » [archive], sur expressio.fr (consulté le ).
- Élisabeth Latrémolière, exposition « Festins de la Renaissance » du 7 juillet au 21 octobre 2012, château Royal de Blois.
Voir aussi
Bibliographie
- Nouveau Larousse illustré, 1898-1907.
- F. de Bonneville, Rêves de blanc. La grande histoire du linge de maison, Paris, Flammarion, .
- Inès Heugel et Christian Sarramon, Dans les armoires de nos grands-mères, Paris, Éditions du Chêne, , 192 p. (ISBN 978-2812300059).
- J.-C. Kaufmann, Le Cœur à l’ouvrage. Théorie de l’action ménagère, Paris, Nathan, coll. « Essais et recherches », .
- « Linge de corps et linge de maison », Ethnologie française, t. 16, no 3, .
Article connexe
Liens externes
-
Serviette de bain
Gros plan d'une serviette de bain, montrant les fibres absorbantes, ainsi qu'un motif décoratif.Une serviette de bain est une pièce de tissu absorbant, généralement de forme rectangulaire, que l'on utilise pour se sécher le corps, après un bain, une douche ou tout autre épisode où on peut être mouillé (piscine, pluie, transpiration etc.). On parle aussi de serviette de toilette voire d'essuie de bain ou encore drap de bain en Belgique et linge (de bain) en Suisse.
Usages
Les serviettes de bain ne servent pas qu'à s'essuyer. Leurs usages sont extrêmement variés et appellent parfois une lecture sémiotique, à l'instar de l'ensemble du linge de maison ou de corps.
Exemples d'usages pratiques :
- On peut s'en servir pour éviter tout contact direct avec le sol, un rocher ou encore une chaise, pour des raisons essentiellement hygiéniques et de confort. Cette pratique est courante dans les saunas, à la plage, ou dans d'autres endroits où la nudité est chose commune. La serviette de bain a ici une fonction d'intermédiaire entre le corps et son environnement. Elle constitue une sorte de « barrière protectrice ».
- Dans le même type de lieux, on peut également utiliser une serviette de bain comme pièce de vêtement rudimentaire, enroulée autour de la taille (comme un kilt), ou en dessous des épaules (pour masquer également la poitrine), à l'instar d'un peignoir. Il s'agit ici d'assurer le respect de la pudeur.
- Une serviette peut aussi servir à enturbanner des cheveux mouillés.
- Certaines personnes l'utilisent pour faire une écharpe soutenant un bras cassé, d'autres pour porter des objets brûlants, comme une manique.
- En cas d'incendie, une serviette humide permet par ailleurs d'étancher une porte, et d'éviter l'asphyxie.
- Pour le soin des personnes alitées, la technique du bain serviette constitue une alternative douce à la toilette traditionnelle.
Exemples d'usages professionnels :
- Les barbiers utilisent des serviettes humides et chaudes pour préparer la peau au rasage.
- Sur les paquebots, on offre à certains clients des animaux en serviette pliés à la façon d'origamis.
- Les publicitaires utilisent fréquemment les serviettes de bain comme support promotionnel.
Exemples d'usages symboliques :
- Les supporters ont parfois une serviette aux couleurs de leur équipe.
- On trouve parfois des serviettes dans des danses folkloriques ou des processions.
Matériaux
Les serviettes de bain sont usuellement en coton, lin et en microfibre.
Dans la culture
« Jour de la serviette » à InnsbruckDans Le Guide du voyageur galactique, les serviettes sont décrites comme l'objet « le plus souvent utile qu'un autostoppeur interstellaire puisse avoir ».[réf. nécessaire] Certains fans de Douglas Adams l'ont pris au mot et la serviette est maintenant considérée comme un symbole de dévotion à cet univers de fiction[réf. nécessaire]. Chaque a lieu le jour de la serviette en mémoire de Douglas Adams.[réf. nécessaire]
Voir aussi
Bibliographie
- Bonneville (de), F, Rêves de blanc. La grande histoire du linge de maison, Paris : Flammarion, 1993.
- Heugel, I. Sarramon, C. Dans les armoires de nos grands-mères. Paris : Éditions du Chêne, 2009.
- Kaufmann J.-C. (1997), Le cœur à l’ouvrage. Théorie de l’action ménagère, Paris, Nathan, Essais et recherches.
- Linge de corps et linge de maison, Ethnologie française, N°3, Tome 16, juillet-.
- Adams Douglas, Le Guide du voyageur galactique, Éditions Folio SF, 1979
Articles connexes
-
Dentifrice
Dentifrice appliqué sur une brosse à dents.Le dentifrice, ou pâte dentifrice, aussi appelée pâte à dents au Canada francophone, est une pâte appliquée sur une brosse à dents pour le nettoyage des dents, il est un complément au brossage qui peut se faire sans dentifrice, celui-ci est secondaire comparé à l'action mécanique du brossage sur la santé bucco-dentaire.
Le dentifrice contribue à l'hygiène bucco-dentaire de plusieurs manières : il permet d'enlever plus facilement la plaque dentaire, évite la mauvaise haleine, et peut contenir des substances qui préviennent les maladies liées aux dents et aux gencives (comme la gingivite). Les deux ingrédients les plus importants sont le fluor qui renforce l'émail et le reminéralise1 et le bicarbonate de soude qui aide à retirer la plaque dentaire, a une activité bactéricide, des propriétés de blanchiment des dents et une capacité à neutraliser l'acidité2,3. Les effets du brossage dentaire dépendent de la manière dont celui-ci est effectué, et non du dentifrice. [réf. nécessaire]
Histoire
On parlait autrefois de « poudre dentifrique »4, poudre officinale5 qui visait à raffermir la gencive et blanchir les dents. Une recette de poudre blanchissante donnée par Louis Joseph Marie Robert (1805) est : Girofle en poudre (dose : un gros), à quoi l'on ajoute de la crème de tartre (dose : un demi-gros), de l'alun calciné (dose : un demi-gros), de la cochenille en poudre (dose : un demi-gros), du sucre (une once), le tout étant à réduire en poudre par porphyrisation6. Mais d'autres recettes ajoutaient à la crème de tartre de la pierre ponce, du « corail préparé », de l'« os desséché », à l'époque appliqué non pas à la brosse à dents, qui n'existait pas, mais « au doigt mouillé de vin ». On l'appelait ainsi car il fallait tremper son doigt dans le vin puis dans le dentifrice en poudre.
Le terme dentifrice vient du latin dentrificum, de dens, dentis : « la dent » et fricare : « frotter »7.
La première référence à une forme de dentifrice se trouve dans un manuscrit égyptien datant du IVe siècle av. J.-C., qui mentionne une mixture à base de sel, de poivre, de feuilles de menthe et de fleurs d'iris8[source insuffisante]. Les Égyptiens de l'Antiquité, eux, employaient un mélange de cendres et d'argile. Les ingrédients exacts du dentifrice restent inconnus9, mais il a été rapporté que son goût est « fonctionnel et plaisant à goûter10. » Déjà dans l'Antiquité on commence à pratiquer l'hygiène bucco-dentaire en utilisant des bâtonnets fibreux à mâcher, comme le siwak, servant de brosse à dents. Les Grecs et Romains de l'Antiquité étoffent certaines de ces recettes en y ajoutant des ingrédients plus abrasifs tels que de la poudre de pierre ponce, de la poussière de marbre, des coquilles d'huîtres broyées, de la poudre d'os pilé ou calciné11.
Au Moyen Âge, le dentifrice reste le plus souvent sous la forme d'une poudre avec différents abrasifs, et est appliqué avec un linge. Jusqu'au XVIIe siècle, l'urine humaine ou animale fermentée12 reste très prisée : elle passe pour avoir un bon effet détergent, désinfectant et de blanchissement des dents13.
Au XVIIIe siècle, Furetière évoque, en 1690, des dentifrices secs (poudres à base de minéraux comme des coraux, pierre ponce, sel et alun ; produits animaux comme des coquilles d’œufs, d’escargots et d’écrevisses, corne de cerf et os de sèche ; et produits végétaux comme des racines cuites avec alun et séchées au four) et humides (distillation d’herbes desséchantes et de médicaments astringents) en usage à l'époque14.
Les premiers dentifrices en pâte commercialisés dans des pots en porcelaine apparurent au XIXe siècle (Colgate étant la première entreprise à les vendre en masse en 1873), mais ils ne parvinrent pas à vaincre la popularité des poudres avant la Première Guerre mondiale. Alors qu'il vendait à ses patients du dentifrice en pot, qu’il fabriquait lui-même, le dentiste Washington Sheffield (en) s'inspira des peintres qui utilisaient les tubes de peinture en métal pour créer en 1892 le premier dentifrice en tube souple en étain, plus pratique et hygiénique15. Samuel Colgate (en) reprit l'idée de Sheffield pour produire en masse et vendre en 1896, les tubes de dentifrice souple en étain et enroulables Colgate Ribbon Dental Creme16.
Divers additifs furent progressivement ajoutés à la pâte. Le fluorure fut ajouté dans le dentifrice durant l'année 1890. Chaque pays détermine une limite maximale à la quantité de fluorure jugée acceptable pour la santé bien qu'un excès de fluor soit considéré comme étant nocif par plusieurs études et que les tablettes, gouttes de fluor et autres compléments alimentaires en contenant nécessitent une prescription en Belgique17.
Au début du XXe siècle, il était conseillé d'utiliser une pâte à base d'eau oxygénée et de bicarbonate de soude. Ce mélange est encore préconisé actuellement pour prévenir- les maladies parodontales. En France, le docteur Pierre Mussot fait réaliser en 1894 par Louis-Maurice Boutet de Monvel une affiche devenue célèbre, ainsi que de grandes publicités murales sur des immeubles hausmanniens dans les années 192018, comme celle de Jean Carlu pour la marque Gellé frères.
Ingrédients et aromates
Dentifrice contenant des particules de microplastique.Le fluor est le principal agent actif de la plupart des dentifrices, et contribue à la prévention des caries : il permet la formation d'une couche d'émail moins soluble (la fluorapatite, de formule Ca5[(PO4)3F), et donc moins sensible aux attaques acides qui induisent les caries19. Le composé le plus fréquent est le fluorure de sodium. Certaines marques emploient du monofluorophosphate de sodium, du fluorure d'étain ou du fluorure d'amine. Aux États-Unis comme en Europe, pratiquement tous les dentifrices vendus dans le commerce contiennent un de ces agents actifs, dans une proportion de 1 000 à 1 100 ppm. Le fait que ce taux soit relativement constant conduit à penser que les dentifrices bon marché sont tout aussi efficaces que les dentifrices plus onéreux. Dans une étude menée en 1998 sur 38 dentifrices, le magazine américain Consumer Reports jugea l'efficacité de 30 d'entre eux excellente20.
Les dentifrices contiennent en général, mais pas toujours, du laurylsulfate de sodium ou un autre type de sulfate21. Le laurylsulfate de sodium est également présent dans d'autres cosmétiques tels que le shampooing, et agit principalement comme agent moussant21. À long terme, l'utilisation d'un dentifrice contenant du laurylsulfate de sodium peut provoquer chez certaines personnes l'apparition d'aphtes21. Des ingrédients tels que du bicarbonate de sodium, des enzymes, des vitamines, des extraits végétaux, du calcium, des produits de bain de bouche, ou encore de l'eau oxygénée sont souvent ajoutés au mélange de base et mis en valeur par les marques pour leurs effets bénéfiques. Il existe de nombreux goûts de dentifrice, la plupart dérivant de la menthe. Il existe cependant des goûts plus « exotiques » incluant anis, abricot, cannelle, fraise, chewing-gum (principalement destiné aux enfants), citron, fenouil, gingembre, orange, vanille, ou même « sans goût ».
Le formaldéhyde, utilisé pour réduire les sensibilités à la douleur en cas de température extrême, n'est plus utilisé aux États-Unis depuis le début des années 1980, mais demeure autorisé dans l'Union européenne.
Le dentifrice doit être recraché après utilisation, mais 5 à 7 % du dentifrice est avalé durant le brossage2. Certains types de dentifrice peuvent provoquer des nausées ou la diarrhée s'ils sont ingérés en trop grande quantité. Chez les très jeunes enfants, un empoisonnement aigu au fluorure peut survenir après ingestion d'aussi peu que 1 pour cent d'un tube de pâte dentifrice aromatisée pour enfants22. Pour les végétariens et les végétaliens, des dentifrices d'origine indienne dépourvus de dérivés animaux ont été introduits dans le commerce.
Aujourd'hui[Quand ?], un dentifrice, constitué essentiellement d'eau, est principalement composé d'excipients : agents polissants (abrasifs composés de silice, bicarbonates de sodium ou phosphates de calcium) influençant sa valeur RDA, agents humectants, agents moussants (à base de tensioactifs), agents épaississants, conservateurs, colorants, édulcorants, arômes ; et de principes actifs : anti-caries (à base de fluor), agents antibactériens (triclosan ou chlorhexidine), agents de blanchiment et anti-tartre.
Types
Dentifrice à rayures
Cette section ne cite pas suffisamment ses sources (septembre 2014).Schéma descriptif montrant comment la pâte de dentifrice sort du tube.Des rayures peuvent être produites à l'aide de deux tubes, un petit tube contenu dans un plus grand, chaque tube contenant une pâte de couleur différente. Lorsque le tube de dentifrice est pressé, les deux pâtes passent à travers un orifice spécialement conçu pour produire le motif à rayures. Ce type de dentifrice a donné lieu à une séquence culte du film Epidemic de Lars von Trier où ce dernier découpe un tube afin d'en découvrir le fonctionnement.
Afin de réduire les coûts de production, il est actuellement courant de remplir les tubes de pâte comportant déjà des rayures. Quand le tube est pressé, les rayures s'écoulent en parallèle et ne se mêlent pas. La pâte à rayures qui sort du tube est simplement une version plus étroite de ce que contient le tube. Le remplissage est effectué à l'aide d'une tête de remplissage multi-buse qui distribue une pâte de couleur différente dans chaque direction. Pour maintenir les rayures parallèles à l'axe du tube, la tête commence en bas et se rétracte au fur et à mesure du remplissage, restant toujours juste au-dessus du niveau de la pâte. Les tubes à deux compartiments sont généralement réservés aux dentifrices contenant deux préparations devant interagir et qui sont ainsi conservées séparées jusqu'au moment de l'utilisation.
Marques populaires
Dentifrices de plusieurs marques.De nombreuses marques sont devenues populaires depuis la commercialisation du dentifrice au XIXe siècle.
En Europe, on trouve les marques Buccotherm, Aquafresh, Dors & Déjà, Émail Diamant, Fluocaril, Sanogyl, Sensodyne, et Tonigencyl en Belgique et en France, les marques Elmex, Meridol, Aronal, Dentamed, Candida, M-Classic, Weleda, et Dentofit en Suisse, les marques Denivit, Parodontax, Vademecum, et Signal en Allemagne et aux Pays-Bas.
Au Canada ce sont les marques (Aquafresh, Arm and Hammer, Colgate-Palmolive, Crest, Sensodyne qui sont populaires (certains dentifrices ayant des effets qui ont été testés de manière indépendante portent le sceau de l'Association dentaire canadienne23).
Aux États-Unis les marquent populaires sont Aim toothpaste, Aquafresh, Arm and Hammer, Close-Up, CloSYSII, Colgate-Palmolive, Crest, Ipana, Macleans, Mentadent, Pepsodent, Sensodyne, Tom's of Maine, Jaan's Paste, et Ultra Brite.
Écoulement
Le dentifrice est un fluide de Bingham : il faut exercer une certaine contrainte de cisaillement pour qu'il commence à s'écouler, en dessous de cette limite, il ne s'écoule pas. De plus, à température ambiante, il est consistant.
Dentifrices et environnement
De nombreux dentifrices, en raison de leur composition, peuvent négativement interagir avec l'environnement. Les problèmes qu'ils posent sont dus à leur :
- teneur en fluor : les dentifrices enrichis en fluor (ou dérivés comme le fluorure stanneux24) sont une source de contamination des eaux d'égouts et des boues de station d'épuration par le fluor ;
- teneur en conservateurs : la plupart des dentrifrices commercialisés contiennent aussi des produits biocides ou des agents conservateurs susceptibles d'interagir avec les microbes présents dans les égouts ou les stations d'épuration ;
- tubes : ce contenant n'est pas biodégradable ; les tubes en aluminium sont de plus en plus rares, généralement remplacés par du plastique souple (potentiellement recyclable, mais a priori plutôt jeté avec les déchets non triés) ;
- teneur en microplastiques. Ces derniers sont des microparticules ou microsphères (Microbeads pour les anglophones) souvent en polyéthylène utilisées comme agent abrasif doux supposés réduire la plaque dentaire et constituant donnant une apparence lisse à la pâte (ou à certains chewing-gum)25, surtout utilisés depuis les années 1990 et pour des raisons de rentabilité économique26. Ils ne sont pas rapidement biodégradables et seront retrouvés dans les eaux grises puis les cours d'eau, estuaires et in fine dans l'environnement marin, car imparfaitement retenus par les filtres de station d'épuration, ou épandus avec les boues dans les champs ou forêts27.
Selon un document publié en 2014 par quatre ONG ayant pour objectif la protection des océans, et/ou la lutte contre la pollution par les microplastiques, de nombreux cosmétiques (les 3/4 des savons et autres produits de gommage contiennent des microplastiques, ainsi que divers shampooings, savons, dentifrices, eye-liners, sticks pour les lèvres, déodorants et un écran solaire peuvent aussi en contenir. Ces microplastiques sont faits de polyéthylène (PE), polypropylène (PP), polytéréphtalate d'éthylène (PET), polyméthacrylate de méthyle (PMMA) ou de nylon, les PE et PP étant les plus communs (en 2012). Des analyses faites pour le compte de la Fondation pour la Mer du Nord (North Sea Foundation) par IVM28 sur plusieurs produits ont trouvé une teneur en microplastiques qui dans un cas atteignait 10,6 % du poids du produit (polyéthylène dans ce cas) soit 21 g pour une dose de 200 ml, qui finissent inéluctablement dans le réseau d'égout. Dans un autre produit examiné lors de cette étude, les chercheurs ont trouvé des particules de PET de très petite taille (50 µm de diamètre). Au vu de ces travaux, la dose moyenne de microplastique utilisée par jour via les dentifrices et cosmétiques serait de 2,4 mg de microplastique/personne et par jour. Ce laboratoire a également trouvé et quantifié des microplastiques dans les stations d'épuration, en aval dans les sédiments marins néerlandais et dans les invertébrés marins (crabes, huître, moule, escargot)29. Certains dentistes notent qu'ils trouvent de plus en plus de microplastiques dans les gencives et craignent des effets sanitaires. Ils recommandent des dentifrices sans plastiques30 (des dentifrices présentés comme plus doux à l'égard de l'environnement (à base d'argile et d'huiles essentielles) existent).
Marques de couleur sur les tubes de dentifrice
Une croyance populaire décrit la marque de couleurs placée sur l'arrière d'un tube de dentifrice comme étant une indication de leur composition, de la manière suivante31,32 :
- Vert : « naturel »
- Bleu : « Naturel + ingrédients médecinaux »
- Rouge : « Naturel + produit chimique »
- Noir : « uniquement produit chimique »
Cette information est un canular circulant depuis au moins 201332. Ces bandes sont des points d'identification optique (eye mark32) utilisés lors de la fabrication du remplissage et/ou de la fermeture du tube ; ce type de système existant de manière identique sur d'autres emballages32.
La notice ou la boîte du dentifrice indique la composition de celui-ci 33,31,34.
Notes et références
- (en) American Dental Association Description of Toothpaste, « Toothpaste » [archive], sur ada.org,
- (en) « Baking soda dentifrices and oral health », The Journal of the American Dental Association, vol. 148, no 11, , S1–S3 (ISSN 0002-8177, DOI 10.1016/j.adaj.2017.09.009, lire en ligne [archive], consulté le )
- (en) « Effect of baking soda in dentifrices on plaque removal », The Journal of the American Dental Association, vol. 148, no 11, , S4–S9 (ISSN 0002-8177, DOI 10.1016/j.adaj.2017.09.004, lire en ligne [archive], consulté le )
- Jacques Christophe Valmont de Bomare (1775), Dictionnaire raisonné universel d'histoire naturelle ; contenant l'histoire des animaux, des végétaux et des minéraux etc. Nouv. éd., rev. et augm. par l'auteur, Paris, Brunet, p. 600
- Simon Morelot Poignée (1803), Manuel du pharmacien-chimiste, Pharmaceutical chemistry, p. 228,916
- Louis Joseph Marie Robert (1805), Manuel de santé ou nouveaux éléments de médecine pratique, d'après l'état actuel de la science et la méthode analytique de Pinel et de Bichat, vol. 2, p. 863
- « Dentifrice : Étymologie de dentifrice » [archive], sur www.cnrtl.fr (consulté le )
- « Les dentifrices industriels » [archive], sur sites.google.com (consulté le )
- (en) Robert W. Lebling Jr., « Flight of the Blackbird », Saudi Aramco World, , p. 24–33 (lire en ligne [archive], consulté le )
- (en) Ivan Van Sertima, The Golden Age of the Moor, Transaction Publishers, , 462 p. (ISBN 1-56000-581-5), p. 267
- Augustin Cabanès, Mœurs intimes du passé : Usages et coutumes disparus, Ligaran, , p. 147.
- L'urine laissée quelques semaines dans un récipient fermé subit la fermentation ammoniacale : plusieurs micro-organismes (le principal étant Micrococcus ureae) hydrolysent son urée en carbonate d'ammoniaque, responsable du pH alcalin et de l'effet détergent. (en) George Miller Sternberg, A Text-book of Bacteriology, Wood, , p. 140.
- Clément David, Hygiène bucco-dentaire du XVIIe au XIXe siècle en France, L'Harmattan, , p. 43-44.
- Furetière, Dictionnaire universel contenant généralement tous les mots françois, tant vieux que modernes, et les termes de toutes les sciences et des arts
- (en) Valerie Wyatt, Inventions, Prentice Hall Books for Young Readers, , p. 46.
- (en) Gabriella Baki et Kenneth S. Alexander, Introduction to Cosmetic Formulation and Technology, John Wiley & Sons, p. 554.
- « Nutriments fluorés déclarés hors-la-loi » [archive], sur lalibre.be, (consulté le )
- Article sur les publicités murales du docteur Mussot [archive]
- « Fundamentals of Dentifrice: Oral Health Benefits in a Tube » [archive], sur http://www.dentalcare.com [archive]
- (en) Kych, « Best tooth paste ever!!! » [archive], sur viewpoints.com (consulté le )
- « Le dentifrice un produit d'usage courant » [archive], sur penntybio.com (consulté le )
- J. D. Shulman et L. M. Wells, « Acute fluoride toxicity from ingesting home-use dental products in children, birth to 6 years of age », Journal of Public Health Dentistry, vol. 57, no 3, , p. 150–158 (ISSN 0022-4006, PMID 9383753, DOI 10.1111/j.1752-7325.1997.tb02966.x, lire en ligne [archive], consulté le )
- « Produits reconnus par l'Association dentaire canadienne » [archive], sur cda-adc.ca
- « The Role of Stannous Fluoride in Maintaining Oral Health » [archive], sur www.pharmacytimes.com (consulté le )
- (Fendall et Sewell 2009), The ones usually found in toothpaste and face wash are even smaller (less than 1 mm).
- Cole, Lindeque, Halsband et Galloway, 2011.
- North Sea Foundation, Marine Conservation Society, Seas At Risk & Plastic Soup Foundation (2012), Micro plastics in personal care products [archive], Position paper, aout 2012
- Institute for Environmental Studies, Instituut voor Milieuvraagstukken [archive]
- H.A. Leslie, M.J.M. van Velzen et A.D. Vethaak (2013), Microplastic survey of the Dutch environment Novel data set of microplastics in North Sea sediments, treated wastewater effluents and marine biota [archive], VM Institute for Environmental Studies, rapport final : 2013-09-09
- Microbeads In Toothpaste & Face Wash [archive], 15 juillet 2014 (consulté le 20 décembre 2014)
- Que signifie le petit carré coloré sur les tubes de dentifrice ? [archive]
- Couleur tubes de dentifrice - Hoaxbuster [archive]
- Que signifient les petites bandes sur les tubes de dentifrices ? [archive]
Annexes
Articles connexes
-
Brosse à dents
Utilisation Usage La brosse à dents est un ustensile destiné, comme son nom l'indique, à se brosser les dents. Elle se présente généralement sous la forme d'une petite brosse au bout d'un manche. Sa fonction est essentielle pour l'hygiène buccale et son usage quotidien est le moyen le plus commode qui ait été inventé par l'homme pour débarrasser les dents des restes alimentaires qui peuvent y demeurer coincés et éliminer la plaque dentaire. La brosse à dents peut aussi servir à nettoyer, par exemple, des joints, des chaussures, des bijoux...
Composants
La brosse à dents est composée1 :
- d'une tête, garnie de touffes formées de brins ;
- d'un manche, permettant la préhension et la manipulation ;
- d'une liaison ou col unissant la tête ou surface garnie au manche.
Usage principal
Un usage minimum (deux fois par jour : le matin après le petit-déjeuner et le soir avant de se coucher selon la Haute Autorité de santé2) ou un usage normal (trois fois par jour après chaque repas selon les dentistes3) est un moyen efficace de lutter contre les caries dentaires, les maladies parodontales et contre la mauvaise haleine (halitose).
Histoire
Bâtonnets de Garcinia kola utilisés comme brosses à dents en Afrique subsaharienneL'usage de diverses techniques pour nettoyer les dents remonte jusqu'à la plus haute Antiquité. De nombreuses fouilles archéologiques partout dans le monde ont mis en évidence toutes sortes d'ustensiles destinés au nettoyage des dents : cure-dents en bois, en plume, en épine, en poil de porc-épic, bois fibreux (tiges en bois de lentisque à l'extrémité effilochée en fibres souples trouvées dans les tombes égyptiennes datant de 3000 ans av. J.-C., bâtons à mâcher, masticatoires à base de noix de kola), etc4. Encore aujourd'hui, on trouve sur les marchés populaires d'Afrique centrale (République démocratique du Congo, Cameroun, Gabon, Angola) des petits bâtonnets d'un bois tendre et très fibreux vendus pour se nettoyer les dents. On trouve également une racine aux propriétés antiseptiques encore utilisée aujourd'hui en Afrique du Nord et en Arabie sous le nom de miswak ou siwak5.
Les Égyptiens se nettoient les dents avec une brosse constituée d'une tige en bois de lentisque sans poils, sur laquelle ils appliquent de l'opiat. Soucieux de leur hygiène dentaire, les Romains de la haute société utilisent des cure-dents et des brosses à dents. Les élégantes se font blanchir les dents avec une mixture fabriquée à base de nitrum ou d'urine humaine (grâce aux sels ammoniacaux qu'elle contient), coutume qui vient d'Espagne selon Diodore de Sicile. 6
Au Moyen Âge, l'usage de la brosse à dent se perd et les gens se contentent de se rincer la bouche avec de l'eau, une soupe de vin ou se frottent les dents avec un linge. La première brosse à dents avec manche et poils en soie naturelle serait apparue en 1498, selon une encyclopédie chinoise de 1609 où elle est figurée par une gravure sur bois7. Elle est fabriquée avec des poils de sanglier (poils suffisamment fins et rigides) piqués sur un manche en bois ou en ivoire. La brosse à dents est introduite en France au XVIe siècle : le bâtonnet surmonté de crins de sanglier est présenté à la cour de France par l'ambassadeur d'Espagne en 15704[Comment ?]. Bien que dénigré par le corps médical qui préconise plutôt les onguents et les pommades pour l'hygiène buccale, il devient un objet de luxe réservé aux plus fortunés qui le portent en sautoir autour du cou, son usage ne se démocratisant qu'au XIXe siècle8. C'est le britannique William Addis qui a probablement mis en œuvre la première brosse à dents produite en série, en 1780. Son entreprise fabrique des brosses à manche d'os avec des poils en crin de cheval. En France, l'entreprise La Brosse et Dupont, créée en 1846 et installée à Beauvais, devient la plus importante fabrique du pays en 18929. Le poil des brosses est fait de soies de blaireau, de chèvre, de porc ou de crins de cheval, de sanglier10 .
Le premier brevet pour une brosse à dents a été déposé par H. N. Wadsworth en 1850 aux États-Unis, mais la production en série en Amérique a commencé seulement en 1885. Elle était alors fabriquée en os, et les poils de la brosse étaient des soies de porc de Sibérie. L'inconvénient majeur de la soie de porc est que la brosse séchait mal, que les bactéries y pullulaient et qu'elle se dégarnissait rapidement. Elle n'était pas idéale pour l'hygiène, à moins de la tremper dans de l'eau de Javel pour la désinfecter. Mais la vérité est surtout que jusqu'à la fin de la Seconde Guerre mondiale, l'habitude de se brosser les dents quotidiennement était peu répandue. Cette mesure d'hygiène a pris son essor parce qu'au départ elle avait été rendue obligatoire pour les militaires.
En outre, la brosse à dents n'a pas cessé d'évoluer. Les poils de sanglier ou de blaireau (généralement issus de leur collier fournissant un poil avec de bonnes racines et une extrémité souple) ont finalement laissé leur place dans les années 1930 aux poils de synthèse au diamètre constant, plus hygiéniques, les poils naturels creux étant des nids à bactéries11. C'est la société DuPont qui introduit pour la première fois la fibre de Nylon en 1938 et la première brosse à dents en Nylon sera mise sur le marché le 24 février de la même année. La fibre synthétique empêche la prolifération des bactéries, mais la dureté des poils rend son usage douloureux. Pour vaincre les réticences, les poils sont assouplis pour un brossage plus confortable. Cette amélioration sera suivie dans les années cinquante par l'invention du manche en celluloïd.
La première brosse à dents électrique, la Broxodent, a été présentée par Squibb Pharmaceutical au centenaire de l'Association dentaire américaine en 1959. Sa mise sur le marché n'a effectivement commencé qu'en 1960.
La dernière brosserie française encore en activité, Duopole, appartenant à La Brosse et Dupont, alors filiale de LVMH, est rachetée en 2005 par le groupe alsacien Samap de Bertrand Zimmer. Menacée de disparaître car sa production est passée en quelques années de 50 à 17 millions de brosses par an, les enseignes de la grande distribution se tournant vers des fabricants chinois, elle se spécialise depuis 2011 dans le haut de gamme9.
Alors que la croissance en valeur du marché de l'hygiène bucco-dentaire stagne en France dans les années 2000, les marques innovent : offres multipacks de Signal en 2004, brosse aux filaments dotés de particules de calcium pour un effet blanchissant ou d'ions argent pour un effet anti-bactérien et lutter contre l'halitose3. Les modèles les plus récents intègrent une tête articulée, une brosse pour la langue sur la face opposée aux poils (le gratte-langue), ou encore des poils dont la couleur s'estompe à mesure que la brosse est utilisée, de sorte que l'utilisateur sache qu'il doit en changer lorsque la couleur a totalement disparu.
En janvier 2015, au salon CES de Las Vegas, la "start-up" française Kolibree12 introduit la première brosse à dents électrique avec connexion sans-fil par Bluetooth. Elle a reçu un prix de l'innovation13.
Fabrication
La fabrication d'une brosse à dents se déroule en trois étapes. Le cycle débute par l'injection de plastique pour la constitution du manche, suivi de « l'empoilage » de l'objet par agrafage de fibres de nylon et s'achève par la réalisation de l'emballage.
Le diamètre du filament et la hauteur de coupe sont les deux paramètres de fabrication qui déterminent le rendu de la brosse à dents, souple, medium ou dur14. Alors que la brosse à dents chirurgicale a un diamètre de poils de 7/100 mm, la brosse à dents souple et medium a un diamètre de 20 à 25/100 mm, la brosse à dents dure qui a un diamètre supérieur n'est pas recommandée, car elle agresse l'émail et la gencive15.
-
Brosses à dents rangées dans un verre à dents
-
Brosse à dents de Napoléon Bonaparte
Notes et références
- Brosses à dents [archive]
- HAS, Stratégies de prévention de la carie dentaire [archive], Synthèse et Recommandations mars 2010 [PDF]
- Marianne Bailly, « L'hygiène bucco-dentaire a encore du potentiel » [archive], sur LSA,
- Clémentine Portier-Kaltenbach, Le Grand Quiz des histoires de France sur RTL, 6 janvier 2013
- Henri Lamendin, Petites histoires de l'art dentaire d'hier et d'aujourd'hui : Anecdodontes, Editions L'Harmattan, , p. 149
- Abdelhakim Charif, Frédéric Duhart, Yannick Le Pape, Anthropologie historique du corps, L'Harmattan, , p. 285.
- Joseph Rechtman, « La Brosse à dents et son histoire (1780-1980) », Histoire des sciences médicales, vol. 14, no 2, , p. 222 (lire en ligne [archive]).
- Anne Pouget, Le Grand Livre des pourquoi : L'Intégrale, Le Cherche Midi, , p. 33.
- Louis Morice, « Faudra-t-il dire adieu à la brosse à dents made in France ? » [archive], sur nouvelobs.com, .
- Ces appendices tégumentaires sont parcourus par un canal médullaire dans lequel les bactéries s'accumulent. Leur remplacement par des brins en nylon évite la prolifération bactérienne. Cf Alain Irsa, Les dents. Histoire, beauté, santé, soins, Flammarion, , p. 139.
- Olivier Remoissonnet, PDG de La Brosserie Française, « En quoi sont faits les poils des brosses à dents ? », émission Les p'tits bateaux de Noëlle Bréham sur France Inter, 16 juin 2013.
- « Kolibree, la brosse à dents intelligente », lesechos.fr, (lire en ligne [archive], consulté le )
- « Cocorico pour Kolibree | Bpifrance servir l'avenir » [archive], sur www.bpifrance.fr (consulté le )
- Noëlle Bréham, « la fabrication des brosses à dents », émission Les p'tits bateaux sur France Inter, 2 décembre 2012
- Pr Guillaume Malquarti, chef du pôle Odontologie des hospices civils de Lyon, « Rendez-vous chez le dentiste », émission À votre service sur RCF, 25 janvier 2013
Voir aussi
Articles connexes
Sources
-
Gant
Pour l’article ayant un titre homophone, voir Gand (homonymie).
Pour les articles homonymes, voir Gant (entreprise).
Gants de laine.Un gant Écouter (du francique *want) est un accessoire de mode, un équipement de sport ou un élément de protection, un élément d'hygiène recouvrant la main. Il est utilisé pour se protéger notamment du froid, ou encore pour le prestige (luxe, cérémonies).
Histoire
« Position correcte. Les quatre doigts sont introduits complètement, ne font plus un pli, c'est le moment de passer le pouce. » La Femme et le gant long, 1905.L'histoire des gants remonte à l'Antiquité. Dans certaines traductions de l'Odyssée d'Homère, Laërte est décrit marchant dans son jardin avec des gants afin de se prémunir contre les mûres sauvages (Il est dit dans d'autres traductions que Laërte avait tiré ses longues manches sur ses mains). Hérodote, dans son Enquête (440 av. J.-C.), raconte comment Léotychidas a été incriminé par un gantelet rempli d'une somme d'argent qu'il avait reçue comme un dessous de table. Xénophon rapportait dans la Cyropédie, que les Perses portaient des moufles en hiver.
En Europe au XIIIe siècle, certaines femmes ont commencé à porter des gants longs comme ornements. Ils étaient faits de lin et de soie et atteignaient parfois le coude. Au XVIe siècle, la reine Élisabeth Ire d'Angleterre a lancé la mode de gants richement brodés et sertis de pierres précieuses. Henri II d'Angleterre a été enterré avec des gants sur les mains. On a également retrouvé des gants sur les mains du roi Jean d'Angleterre quand son tombeau a été ouvert en 1797, et sur celles du roi Édouard Ier quand son tombeau a été ouvert en 1774.
Largeur et longueur
En largeur, les gants sont fabriqués en pouce anglais, soit 2,54 centimètres. Il est à noter que Xavier Jouvin, gantier grenoblois et inventeur de la " main de fer ", avait établi des calibres pour 32 largeurs de main et que les mesures définies étaient en centimètres et en millimètres au moment où il a déposé son brevet vers 1837. Toutefois, les fabricants de gants, notamment du fait de l'importance des pays où les mesures anglaises existent ou en fonction des débouchés où les mesures britanniques sont adoptées, n'ont pas adopté les largeurs de gants, en centimètres, selon les calibres mis au point par Xavier Jouvin vers 1837 et ont retenu la mesure en largueur de gant, selon les caractéristiques de mesure britanniques. La mesure du tour de main afin de connaître la largeur du modèle désiré - faite en centimètres - est alors à diviser par 2,54 afin d'avoir une mesure en pouces, pour obtenir la taille des gants à acheter. La mesure moyenne en largeur de gants pour une femme est d'environ 7, 5 pouces, soit environ 19 centimètres ; pour un homme, la largeur de la main étant plus forte, elle correspond 9 pouces, soit près de 23 centimètres.
En longueur, les références de fabrication sont calculés en mesures britanniques (en pouces) mais il est tout possible de les calculer en " boutons " , c'est-à-dire une ancienne mesure française d'avant la Révolution française qui correspondait à un douzième de ce qui était appelé le " pied de Charlemagne " (soit environ 31,35 centimètres). Le " bouton " est égal à un douzième de ce pied, soit environ 2, 60 centimètres. Il est à noter que cette mesure de pied français a été changée en 1668, par Jean-Baptiste COLBERT, contrôleur général des Finances et a été légèrement augmentée, afin d'atteindre une longueur qui correspondait à environ 32,48 centimètres. Ainsi, la longueur du " bouton " après 1668 est d'environ 2,7 centimètres. Cette mesure est restée inchangée, jusqu'en 1795, année d'apparition du système métrique en France et rendu obligatoire en 1800. Ainsi, les gants courts pour femmes sont d'environ des huit " boutons ", soit environ 22 centimètres. Des gants pour femmes recouvrant l'avant bras, allant jusqu'au coude, sont ainsi des 16 " boutons " et ont une longueur d'environ 44 centimètres. Quant aux gants allant jusqu' à l'épaule - soit les " gants opéra " les plus longs - , ils sont des 30 " boutons " , soit d'une longueur d'environ 80 centimètres. Toutefois, la longueur moyenne des " gants opéra " est d'environ 59 - 60 centimètres et correspond à une longueur de 22 " boutons ".
Ganterie
Grenoble, les gantiers, carte postale, 1904.Main chauffante — outil de gantier grenoblois.En France, les corporations de gantiers (datant de 1342) s'installèrent surtout dans des régions où se pratiquait l'élevage intensif de chevreaux et d'agneaux, et où l'eau des rivières était pure et propice au tannage : dans le Massif central à Saint-Junien (voir Ganterie de Saint-Junien) ou à Millau, dans le Dauphiné (voir Ganterie Jouvin et Ganterie Perrin, à Grenoble), le sud de la Champagne (voir ganterie Tréfousse), à Niort (chamoiserie) ou à Caudebec-en-Caux. On trouve également une rue Ganterie à Rouen (rue des Gantiers au XIVe siècle) et à Caen, une rue [de la] Ganterie à Poitiers.
Aujourd'hui, les gants sont fabriqués dans le monde entier. La plupart des prototypes et des petites séries de gants de luxe pour femmes continuent à être fabriqués en France. Cependant, les productions sont le plus souvent assurées dans les usines d'Europe de l'Est et d' Asie, ou encore au Canada.
Gloversville (de l'anglais glove signifiant « gant ») est un centre de fabrication de gants aux États-Unis.
La fabrication des gants a lieu en Asie de l'Est et ce, depuis les années 1980, notamment en raison de la faiblesse du coût du travail local.
En 2022, la ganterie française regroupe environ 15 fabricants de gants de ville, de gants sport et de gants de travail. Environ 270 personnes sont actuellement employées dans ce secteur. Les lieux de production sont principalement Millau, Saint-Junien et Grenoble, patrie de M. Xavier Jouvin, inventeur du premier calibre, déposé en 1832 et des premiers modèles au nombre de 32 et des 322 largeurs de gants, permettant ainsi la production de la découpe en série des paires de gants, alors toutes découpées à la main. La fédération de la ganterie française, fondée en 1930 sous un autre nom, regroupe en 2022, seulement sept sociétés ou artisans : gants Agnelle, gants Causse, Atelier du Gantier, Morand, Lesdiguières-Barnier, Ganterie Maroquinerie de Saint-Junien (ancienne coopérative de production ouvrière, créée vers 1920 et possédée après les années 2000 par Hermès), Lavabre-Cadet (devenu la propriété de la société Camille Fournet). Moins de 10 % des gants diffusés en France sont fabriqués en France, en Espagne ou en Italie, dans les années 2020.
La quasi-totalité des gants bon marché ou très bon marché est fabriquée en Chine (République populaire de Chine), en Inde, au Pakistan et au Bangla-Desh.
Certains gants de bonne qualité ou de qualité moyenne sont fabriqués dans certains pays est-européens, comme la Hongrie et la Roumanie.
La ganterie française de qualité est concurrencée par celle du Portugal, de Espagne et de l' Italie.
Fonctions
Au Moyen Âge, les gants blancs étaient utilisés par les évêques, les archevêques et le pape : des gants épiscopaux. C’est à partir du XIXe siècle qu’ils prirent d’autres fonctions. Les Anglais commencèrent à demander à leurs domestiques de porter des gants blancs pour cacher leurs mains abîmées par le travail. Pour les Francs Maçons, cet accessoire est une caractéristique d’appartenance au groupe représentant honneur et pureté. Quant aux mariées, le but était d’être en accord avec leur robe blanche tout en étant distinguée1.
Coutumes
Au XVIIe siècle le gant, symbole de pureté et de noblesse, incarne une marque de soumission et de respect envers la couronne. Pour ne pas offenser le roi et lui montrer sa loyauté, retirer ses gants devant lui, ainsi que dans ses écuries était de coutume. Les juges royaux lors de leur exercice les ôtaient également, comme les hommes devant les femmes en gage d’élégance, ou au moment d’abattre l'animal lors de la chasse à courre2.
Gantelet
Le gantelet est une sorte de gant couvert de lames de fer sur le dos de la main ; il fait partie de l'armure.
Paire de gantelets, Allemagne, fin du XVIe siècle.Gants de travail
Panneau indiquant que le port de gants est obligatoire.Électricien portant des gants isolants.Les gants constituent un équipement de protection individuelle indispensable dans de nombreux domaines (le port des gants étant obligatoire en France pour certains travaux selon le Code du travail) :
- Gants de manutention, pour protéger les mains contre l'abrasion ou l'écrasement, souvent en cuir épais ou bien des gantelets en métal (pour certains travaux).
- Gants de protection thermique pour les personnes travaillant dans la chaleur (pompiers, métallurgistes, soudeurs) ou le froid (frigoristes, travailleurs dans les pays froids, manipulateurs d'azote ou d'hélium liquide) ; gants de cuisine (en tissu épais, parfois en kevlar).
- Gants diélectriques pour travaux sous tension, à utiliser éventuellement avec surgants en cuir.
- Gants de protection contre les produits chimiques ou biologiques (laboratoires, industrie chimique, professions de santé), en latex, PVC ou nitrile.
- Gants anti-vibrations.
- Gants médicaux : le gant médico-chirurgical a été utilisé pour la première fois en 1894 par un médecin du nom de Halsted, pour une intervention chirurgicale à l'hôpital Johns-Hopkins de Baltimore. Les gants à usage médical sont pour la plupart fabriqués soit à partir de caoutchouc naturel (par exemple en latex) ou synthétique (en cas d'allergie), soit à partir de polymères thermoplastiques.
- Gants de protection contre les coupures (bouchers), en écaille métallique ou de type cotte de mailles.
Différents types de gants
Gants de motard.Gants de baseball.- Gants à crispin, sorte de gants en vogue au XVIIe siècle chez les hommes et les femmes. Ils se caractérisent par une manchette à revers de cuir ornemental souvent à franges ou brodés.
- Gants parlants
- Gants de ville
- Gants chauffants
- Gants de conduite
- Gants de soirée
- Gants de mariée
- Gants orthopédiques
- Gants de toilette
- Gants de protection thermiques voir : manique (protection thermique)
- Gants isolants (électriciens) classés selon la tension d'utilisation (500 à 36 000 volts)
- Gants hydrofuges et cryogénique
- Gants de protection chimique et de nettoyage
- Gants antisalissures
- Gants anti-coupure(s) et perforation(s)
- Gants anti-abrasion
- Gants antiagents pathogènes
- Gants de palpation
- Gants de Benedetti (protection thermique)
Certains gants sont à usage mixte, tels que, par exemple, les gants de jardinage qui sont des gants antisalissures, anti-abrasion, anti coupures et anti-perforations.
- Dans les sports :
- Gants de baseball
- Gants de boxe
- Gants de cycliste
- gardien de but (football)
- Gants de hockey sur glace/sur roller
- Gants de motard3
- Gants de ski
- Gants de golf (souvent à une seule main).
- Gants pour le tir à l'arc et le Kyudo appelé gake.
- gants de voile et planche à voile (en général des mitaines, combinant protection de la paume et des phalanges inférieures contre le frottement des cordages ou du wishbone avec l'agilité du bout des doigts.
- Les gants pontificaux sont des accessoires liturgiques utilisés principalement par le pape, les cardinaux et les évêques. Cet usage remonte au Xe siècle.
- Les gants de latex, omniprésents dans la chirurgie, ont été créés par la société australienne Ansell.
- Dans la réalité virtuelle, on utilise un gant de données.
- Gant marionnette
- Les magiciens portent souvent des gants blancs.
- Les voitures sont équipées d'une « boîte à gants ».
Moufle ou mitaine
Exemples de mitaines.Une moufle est un gant sans séparation entre les doigts (sauf pour le pouce) le plus souvent en laine ou en fibre synthétique, supportée au ski ou en plein air. Il permet une meilleure protection des mains contre le froid, au prix d'une moins bonne mobilité. Elles sont fabriquées au Moyen Âge en fourrure pour les membres du clergé ou en peau de cerf, de chien pour les fauconniers, les chasseurs. Le terme remonte peut-être au vieux bas francique *molfëll « peau molle » (Kluge, s.v. Muff 1) ou plus vraisemblablement à deux éléments du vieux bas francique *muff- et -vël, sur la base du radical muffel « museau rebondi » (cf. l'allemand muffeln « mâchonner ; envelopper », et le français camouflet) qui aurait signifié aussi « enveloppe » par analogie de forme et de vël « peau d'animal »4,5 (cf. allemand Fell « peau d'animal », apparenté par l'indo-européen au latin pellis « peau »).
Une mitaine (emploi plus souvent pluriel : des mitaines) est un gant dont les doigts ne sont pas fermés, comme s'ils avaient été coupés. Parfois même les doigts ne sont pas délimités et la mitaine ne couvre que la paume et le dessus de la main. Comme les gants, les mitaines peuvent monter plus ou moins haut sur le bras. La mitaine est généralement considérée comme un accessoire féminin, même si elle tend à se masculiniser. Elles peuvent se porter seules ou superposées sur un gant. Les mitaines présentent l'avantage de tenir les mains au chaud tout en préservant la sensibilité tactile de la pulpe des doigts.
Le terme dérive de l'ancien français mite à l'aide du suffixe -aine. Il s'agit probablement d'un emploi métaphorique de l'ancien français mite « nom de caresse de la chatte » (cf. mistigri), à cause de la fourrure de l'animal6, sans doute allusion à la douceur de la fourrure de cet animal. L'étymologie pourrait également renvoyer au terme allemand Mitte7 qui signifie « milieu » ; en allemand, les mitaines se disent Mitten, soit des gants dont les doigts ne sont protégés que jusqu'au milieu ou qui sont coupés à moitié.
Au Canada, toutefois, mitaine signifie « moufle », signification ancienne ou régionale en français.
Si la mitaine a d'abord une fonction utilitaire, laissant les extrémités des doigts nues et libres de travailler, elles deviennent dès le XVIIIe siècle des accessoires de mode, portées en intérieur par les dames dans un but uniquement esthétique. Cette mode subsistera jusqu'au XIXe siècle. Ces mitaines d'intérieur étaient diverses : tricotées, brodées, en crochet, en résille ou en dentelle. Elles s'arrêtaient au poignet ou au coude.
La mitaine est remise au goût du jour par Madonna dans ses premiers clips, dans les années 1990.
Matériaux utilisés pour fabriquer des gants
Gants de cuir.Gant en PVC.- cuirs et peaux
- laine
- soie
- coton
- caoutchouc
- latex
- nitrile
- néoprène
- silicone
- vinyle
- métal inoxydable réalisé en Cotte de mailles
- résille élément parfois utilisé dans le style post-punk ou dans la mode gothique
Normes
- Sapeurs-pompiers :
- normes EN 420, EN 60-903 : gants d'électriciens
- norme EN 659 : gants de protection pour sapeurs-pompiers
- norme ISO 15383 : gants de protection pour sapeurs-pompiers
- norme EN 374-1 : gants de protection contre les produits chimiques et les micro-organismes
- norme EN 374-2 : gants de protection adaptés à la résistance et la pénétration (à l’air ou à l’eau)
- norme EN 374-3 : gants de protection adaptés à la perméation des produits chimiques
- norme EN 388 : gants de protection contre les risques mécaniques
- norme EN 407 : gants de protection contre les risques thermiques
- norme EN 511 : gants de protection contre le froid
- norme EN 421 : gants de protection contre les rayonnements ionisants et la contamination radioactive
- norme EN 12477 : gants de protection pour soudeurs
- norme EN 1149 : propriétés électrostatiques
- norme EN 13594 (2015) : gants de protection pour motocyclistes
Ces normes correspondent à des exigences de performance tout en définissant les méthodes d’essai en laboratoire qui permettent de les évaluer.
Expressions
- Aller comme un gant : correspondre parfaitement
- Jeter le gant : lancer un défi
- Prendre des gants : traiter quelqu'un avec beaucoup de ménagement
- Raccrocher les gants : arrêter la boxe (par extension : arrêter un projet)
- Relever le gant : accepter un défi
- Une main de fer dans un gant de velours : avoir de l'autorité tout en se montrant diplomate
Notes et références
- Sophie George, Les Accessoires de A à Z, volume 2, Paris, édition falbalas, 320 p. (ISBN 9782953024050)
- Sophie George, Les Accessoires de A à Z, Volume 2, Paris, édition falbalas, 320 p. (ISBN 9782953024050)
- « Spécificités des gants moto » [archive]
- FEW t.16, p.576b.
- : Site du CNRTL : étymologie de "moufle" [archive]
- Site du CNRTL : étymologie de "mitaine" [archive]
- « Traduction milieu allemand | Dictionnaire français-allemand | Reverso » [archive], sur dictionnaire.reverso.net (consulté le )
Voir aussi
Articles connexes
- Gant médical
- Gant du soir
- Ganterie grenobloise
- Gant électronique
- Gant (hockey sur glace)
- Chaussette à orteils, aussi appelée « chaussette-gant » à cause de son concept
- Monogant
- Manique (cuisine)
- Power Glove, une manette de jeu en forme de gant
- Witchblade, bande dessinée mettant en scène un gantelet magique
Liens externes
- Ressource relative à la santé
- :
- (en) PatientLikeMe
-
Notices dans des dictionnaires ou encyclopédies généralistes





















































![Déboucheur contenant du H2SO4 concentré[1].](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d2/Acidic_drain_cleaner_containing_sulfuric_acid_%28sulphuric_acid%29.jpg/120px-Acidic_drain_cleaner_containing_sulfuric_acid_%28sulphuric_acid%29.jpg)